
(共12分) 工业上以锂辉石(Li2O·Al2O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:
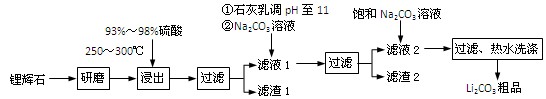
已知:① Li2O·Al2O3·4SiO2 H2SO4(浓)
H2SO4(浓) Li2SO4
Li2SO4 Al2O3·4SiO2·H2O↓
Al2O3·4SiO2·H2O↓
② 某些物质的溶解度(S)如下表所示:
|
T/℃ |
20 |
40 |
60 |
80 |
|
|
1.33 |
1.17 |
1.01 |
0.85 |
|
|
34.2 |
32.8 |
31.9 |
30.7 |
③ 从滤渣1中分离出Al2O3的部分流程如下图所示:

(1)、请依次写出在括号内加入试剂的化学式 、 。
(2)、请依次写出方框中所得到物质的化学式 、 。
(3)、步骤Ⅰ中反应的离子方程式是 。
(4)、已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(运用化学平衡原理简述) 。
(5)、向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是
。
(6)、氧化铝在工业上用作高温耐火材料,制耐火砖、坩埚、瓷器、人造宝石等,同时氧化铝也是炼铝的原料。写出用氧化铝炼铝的化学方程式: 。
(1). HCl(其它合理答案也给分) (1分) NH3·H2O (1分)
(2). AlCl3 (其它合理答案也给分) (1分) Al(OH)3 (1分)
(3). Al2O3+6H+→Al3++3H2O (2分)
(4). 增加Ca2+、OH-的浓度,有利于Mg(OH)2、CaCO3的析出(其它合理答案也给分) (2分)
(5). Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失(2分)
(6).2Al2O3(熔融) 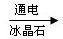 4Al+3O2↑ (2分)
4Al+3O2↑ (2分)
【解析】(1).滤渣中含有氧化铝和二氧化硅,氧化铝是两性氧化物,所以先加入盐酸,将氧化铝溶解过滤及得到氯化铝溶液,然后通入氨气即可得到氢氧化铝沉淀,氢氧化铝灼烧即得到氧化铝。
(2)略
(3)氧化铝和盐酸反应的离子方程式为 Al2O3+6H+→Al3++3H2O。
(4)加入石灰乳,可以增加Ca2+、OH-的浓度,有利于平衡向生成Mg(OH)2、CaCO3的方向进行。
(5)根据溶解度可知, Li2CO3的溶解度随温度升高而减小,所以热水洗涤可减少Li2CO3的损失。
(6)氧化铝电解生成越强和单质铝,方程式为2Al2O3(熔融) 4Al+3O2↑ 。
4Al+3O2↑ 。


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源:2011-2012年重庆西南大学附中高二下学期期中考试化学试卷(带解析) 题型:填空题
(12分)钛(Ti)被誉为“21世纪的金属”。工业上将TiO2与焦炭混合,通入Cl2高温下制得TiCl4;再将TiCl4提纯后,在氩气保护下与镁高温反应制得Ti。其反应如下:
①TiO2+2Cl2+2C TiCl4+2CO
TiCl4+2CO
②TiCl4+2Mg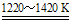 Ti+2MgCl2
Ti+2MgCl2
回答下列问题:
(1)Ti元素原子的价电子排布式为_____________________。
(2)与CO互为等电子体的分子是___________。
(3)已知TiCl4在通常情况下是无色液体,熔点为–37℃,沸点为136℃;TiCl4在潮湿空气中易水解产生白雾,同时产生H2TiO3固体。
① TiCl4为______化合物(填“离子”或“共价”)。
② TiCl4分子为正四面体形,则Ti为________杂化。
③ TiCl4在潮湿空气中水解的化学方程式是_____________________________________。
④TiO2、Cl2和C反应制得的TiCl4最好的提纯方法是____________ (填操作名称)。
(4)配离子[TiCl(H2O)5]2+的中心离子化合价为 ,中心离子配位数为 。
查看答案和解析>>
科目:高中化学 来源:2012届上海市普陀区高三4月质量调研(二模)化学试卷(带解析) 题型:实验题
(本题共12分)海水中有丰富的卤素资源,含量最高的食盐(NaCl)不但是人类生活不可缺少的物质,而且是重要的化工原料。
(1).实验室里常用NaCl制取HCl。请在下图中选择合适的仪器用于发生HCl气体:
(填写仪器编号)。
(2).在实验室里使用与制取HCl相同的实验装置和条件,将浓硫酸滴入NaBr(s),可以观察到的现象是 。
(3).产生上述现象的原因是 。
(4).收集HCl(g)和HBr(g)的实验时不可缺少的实验操作是: 。
(5).除水之外,限用 HCl(g)、HBr(g)和HI(g),还需要 (填写试剂的化学式),就能设计实验比较氯、溴、碘的化学活泼性。
(6).工业上可用食盐作为一种主要原料,经不同的方法生产纯碱。联合制碱法(侯氏制碱法)与氨碱法(索氏制碱法)相比,其优点是: 、 和避免产生大量含CaCl2的废液。
查看答案和解析>>
科目:高中化学 来源:2012届上海市崇明县高三高考模拟考试(二模)化学试卷(带解析) 题型:填空题
(共12分) 工业上以锂辉石(Li2O·Al2O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下: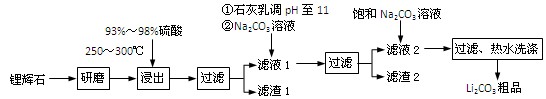
已知:① Li2O·Al2O3·4SiO2 H2SO4(浓)
H2SO4(浓) Li2SO4
Li2SO4 Al2O3·4SiO2·H2O↓
Al2O3·4SiO2·H2O↓
② 某些物质的溶解度(S)如下表所示:
| T/℃ | 20 | 40 | 60 | 80 |
 (Li2CO3)/g (Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
 (Li2SO4)/g (Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |

查看答案和解析>>
科目:高中化学 来源:2011-2012学年上海市普陀区高三4月质量调研(二模)化学试卷(解析版) 题型:实验题
(本题共12分)海水中有丰富的卤素资源,含量最高的食盐(NaCl)不但是人类生活不可缺少的物质,而且是重要的化工原料。
(1).实验室里常用NaCl制取HCl。请在下图中选择合适的仪器用于发生HCl气体:
(填写仪器编号)。
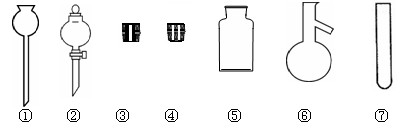
(2).在实验室里使用与制取HCl相同的实验装置和条件,将浓硫酸滴入NaBr(s),可以观察到的现象是 。
(3).产生上述现象的原因是 。
(4).收集HCl(g)和HBr(g)的实验时不可缺少的实验操作是: 。
(5).除水之外,限用 HCl(g)、HBr(g)和HI(g),还需要 (填写试剂的化学式),就能设计实验比较氯、溴、碘的化学活泼性。
(6).工业上可用食盐作为一种主要原料,经不同的方法生产纯碱。联合制碱法(侯氏制碱法)与氨碱法(索氏制碱法)相比,其优点是: 、 和避免产生大量含CaCl2的废液。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com