
 CO2↑+2SO2↑+2H2O;
CO2↑+2SO2↑+2H2O; CO2↑+2SO2↑+2H2O;A;
CO2↑+2SO2↑+2H2O;A;

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
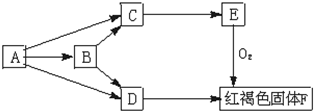 中学化学常见物质A、B、C、D、E有如下转化(已知A、B、C、D、E均含有同一元素):
中学化学常见物质A、B、C、D、E有如下转化(已知A、B、C、D、E均含有同一元素):
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2013-2014学年福建省等五校高三上学期期中联考化学试卷(解析版) 题型:填空题
中学化学常见物质A在一定条件下发生如下反应:A+B→E+F+H2O(未配平)
(1)若A为小苏打,F为气体。该反应的离子方程式为 。
(2)若A为紫红色金属单质,气体F是由两种位于同一主族的短周期元素组成。则E的化学式为________。
(3)若A是磁铁矿的主要成分,B是盐酸。写出反应的化学方程式为 。
(4)若A为黄绿色气体单质,F的碱性溶液吸收废气中SO2的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年福建省高三上学期第三阶段考试化学试卷(解析版) 题型:填空题
中学化学常见物质A在一定条件下发生如下反应:A+B→E+F+H2O(未配平)
(1)若A为小苏打,F为气体。该反应的离子方程式为 。
(2)若A为紫红色金属单质,气体F是由两种位于同一主族的短周期元素组成。则反应的化学方程式为_____________________。
(3)若A是磁铁矿的主要成分,B是盐酸。写出反应的化学方程式为 。
(4)若A为黄氯色气体单质,F的碱性溶液吸收废气中SO2的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2012年甘肃省庆阳市庆城县陇东中学高考化学三模试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com