
【题目】工业上冶炼下列金属,常采用热分解法的是
A.AlB.FeC.NaD.Ag
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】化学与人类生活和社会可持续发展关系密切。下列措施正确的是
①将酒精和84消毒液混用,提高杀灭新冠病毒的效果;②研发易降解的生物农药;③应用高效洁净的能源转换技术;④田间焚烧秸秆;⑤推广使用节能环保材料
A.①③⑤B.②③⑤C.①②④D.②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国炼丹家约在唐代或五代时期掌握了以炉甘石点化鍮石(即鍮石金)的技艺:将炉甘石(ZnCO3)、赤铜矿(主要成分Cu2O)和木炭粉混合加热至800℃左右可制得与黄金相似的鍮石金。回答下列问题:
(1)锌元素基态原子的价电子排布式为________________,铜元素基态原子中的未成对电子数为_________________。
(2)硫酸锌溶于过量氨水形成[Zn(NH3)4]SO4溶液。
①[Zn(NH3)4]SO4中,阴离子的立体构型是__________________,[Zn(NH3)4]2+中含有的化学键有__________________。
②NH3分子中,中心原子的轨道杂化类型为________________,NH3在H2O中的溶解度____________(填“大”或“小”),原因是_____________________。
(3)铜的第一电离能为I1Cu=745.5kJ·mol-1,第二电离能为I2Cu=1957.9kJ·mol-1,锌的第一电离能为I1Zn=906.4kJ·mol-1,第二电离能为I2Zn=1733.3kJ·mol-1,I2Cu>I2Zn的原因是___________________。
(4)Cu2O晶体的晶胞结构如图所示。O2-的配位数为_______________;若Cu2O的密度为dg·cm-3,则晶胞参数a=____________nm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的的是
A.只含非金属元素的化合物一定是共价化合物
B.Na2CO3和CaCl2中化学键类型完全相同
C.含有共价键的物质不一定是共价化合物
D.溶于水能导电的化合物一定是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粉末状样品A是由等物质的量的MgO和Al2O3与常见金属氧化物B组成的混合物。A有如图所示的转化关系。
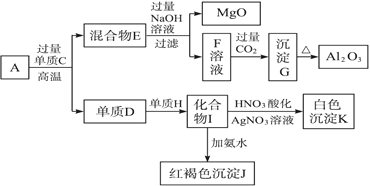
请完成下列问题:
(1) 金属单质C和非金属单质H的化学式分别是__________、_______________
(2) 写出由I生成J的离子方程式:___________________
(3) 写出由F生成G的离子方程式:____________________________
(4) 若10.7 g样品A中MgO、Al2O3和B的物质的量均为0.05 mol,则B的化学式为___________。
(5) 若B中金属原子与氧原子的粒子数之比为2∶3,取7.10 g样品A恰好与含x mol HCl的盐酸完全反应,则x的取值范围是___________(保留小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为证实氢氧化钡溶液和硫酸溶液的反应是离子反应,实验设计和过程如下:如图所示连接好装置,向烧杯中加入25 mL 1 mol·L-1的氢氧化钡溶液和2滴酚酞溶液,再一边不断地滴加1 mol·L-1的硫酸溶液,并轻轻振荡。试完成下列内容:

(1)实验现象及①溶液颜色变化为______,原因是________。
②灯泡亮度变化:__________,原因是_______。
③溶液变浑浊,原因是___________。
(2)实验结论:稀硫酸与氢氧化钡溶液反应的实质是_____(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置,其中试剂b为浓硫酸,则下列实验设计能达到实验目的的是
选项 | 试剂a | 试剂c | 实验目的 |
|
A | MnO2和NaCl | 紫色石蕊溶液 | 验证Cl2的漂白性 | |
B | 蔗糖 | 澄清石灰水 | 验证CO2的生成 | |
C | FeS | 溴水 | 验证非金属性:Br>S | |
D | Na2SO3 | 品红溶液 | 验证SO2的漂白性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类生存、社会发展不可或缺的物质,CO、H2、CH3OH均是重要的能源物质。
(1)已知:氧气中化学键的键能为497kJ/mol,二氧化碳中C=O键的键能为745kJ/mol。
2CO(g)+O2(g)=2CO2(g) △H1=-566kJ/mol
H2O(g)+CO(g)=H2(g)+CO2(g) △H2=-41kJ/mol
CH3OH(g)+![]() O2(g)==CO2(g)+2H2O(g) △H3=-660kJ/mol
O2(g)==CO2(g)+2H2O(g) △H3=-660kJ/mol
CO(g)+2H2(g)![]() CH3OH(g) △H4
CH3OH(g) △H4
则使1molCO(g)完全分解成原子所需要的能量至少为___,△H4=___。
(2)某密闭容器中存在反应:CO(g)+2H2(g)![]() CH3OH(g),起始时容器中只有amol/LCO和bmol/LH2,平衡时测得混合气体中CH3OH的物质的量分数[φ(CH3OH)]与温度(T)、压强(p)之间的关系如图所示。
CH3OH(g),起始时容器中只有amol/LCO和bmol/LH2,平衡时测得混合气体中CH3OH的物质的量分数[φ(CH3OH)]与温度(T)、压强(p)之间的关系如图所示。
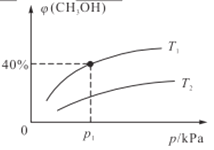
①温度T1和T2时对应的平衡常数分别为K1、K2,则K1____K2(填“>”“<”“=”);若恒温(T1)恒容条件下,起始时a=1、b=2,测得平衡时混合气体的压强为p1kPa,则T1时该反应的压强平衡常数Kp=___。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,用含p1的代数式表示)
②若恒温恒容条件下,起始时充入1molCO和2molH2,达平衡后,CO的转化率为α1,此时,若再充入1molCO和2molH2,再次达平衡后,CO的转化率为α2,则α1_____α2 (填“>”“<”“=”“无法确定”)
③若恒温恒容条件下,起始时a=1、b=2,则下列叙述能说明反应达到化学平衡状态的是____。
A.CO、H2的物质的量浓度之比为1:2,且不再随时间的变化而变化
B.混合气体的密度不再随时间的变化而变化
C.混合气体的平均摩尔质量不再随时间的变化而变化
D.若将容器改为绝热恒容容器时,平衡常数K不随时间变化而变化
(3)工业上常用氨水吸收含碳燃料燃烧中产生的温室气体CO2,其产物之一是NH4HCO3。已知常温下碳酸的电离常数K1=4.4×10-7、K2=4.7×10-11,NH3·H2O的电离常数K=1.8×10-5,则所得到的NH4HCO3溶液中c(NH4+)_____c(HCO3-)(填“>”“<”“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com