
【题目】能源是人类生存、社会发展不可或缺的物质,CO、H2、CH3OH均是重要的能源物质。
(1)已知:氧气中化学键的键能为497kJ/mol,二氧化碳中C=O键的键能为745kJ/mol。
2CO(g)+O2(g)=2CO2(g) △H1=-566kJ/mol
H2O(g)+CO(g)=H2(g)+CO2(g) △H2=-41kJ/mol
CH3OH(g)+![]() O2(g)==CO2(g)+2H2O(g) △H3=-660kJ/mol
O2(g)==CO2(g)+2H2O(g) △H3=-660kJ/mol
CO(g)+2H2(g)![]() CH3OH(g) △H4
CH3OH(g) △H4
则使1molCO(g)完全分解成原子所需要的能量至少为___,△H4=___。
(2)某密闭容器中存在反应:CO(g)+2H2(g)![]() CH3OH(g),起始时容器中只有amol/LCO和bmol/LH2,平衡时测得混合气体中CH3OH的物质的量分数[φ(CH3OH)]与温度(T)、压强(p)之间的关系如图所示。
CH3OH(g),起始时容器中只有amol/LCO和bmol/LH2,平衡时测得混合气体中CH3OH的物质的量分数[φ(CH3OH)]与温度(T)、压强(p)之间的关系如图所示。
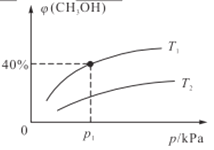
①温度T1和T2时对应的平衡常数分别为K1、K2,则K1____K2(填“>”“<”“=”);若恒温(T1)恒容条件下,起始时a=1、b=2,测得平衡时混合气体的压强为p1kPa,则T1时该反应的压强平衡常数Kp=___。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,用含p1的代数式表示)
②若恒温恒容条件下,起始时充入1molCO和2molH2,达平衡后,CO的转化率为α1,此时,若再充入1molCO和2molH2,再次达平衡后,CO的转化率为α2,则α1_____α2 (填“>”“<”“=”“无法确定”)
③若恒温恒容条件下,起始时a=1、b=2,则下列叙述能说明反应达到化学平衡状态的是____。
A.CO、H2的物质的量浓度之比为1:2,且不再随时间的变化而变化
B.混合气体的密度不再随时间的变化而变化
C.混合气体的平均摩尔质量不再随时间的变化而变化
D.若将容器改为绝热恒容容器时,平衡常数K不随时间变化而变化
(3)工业上常用氨水吸收含碳燃料燃烧中产生的温室气体CO2,其产物之一是NH4HCO3。已知常温下碳酸的电离常数K1=4.4×10-7、K2=4.7×10-11,NH3·H2O的电离常数K=1.8×10-5,则所得到的NH4HCO3溶液中c(NH4+)_____c(HCO3-)(填“>”“<”“=”)。
【答案】 958.5kJ -107kJ/mol > 25/(2p12)(kPa)-2 < CD >
【解析】分析:反应等于反应物的键能总和与生成物键能总和的差。根据盖斯定律可以由已知反应的反应热求出与之相关的未知反应的反应热。放热反应的平衡常数随温度升高而减小。在恒温恒容的平衡体系中再充入与原投料相同的反应物,则平衡向气体分子数减少的方向移动,反应物转化率增大。由水解程度可以比较离子浓度的大小关系。
详解:(1)由题中信息可知,2CO(g)+O2(g)=2CO2(g) △H1=-566kJ/mol,氧气中化学键的键能为497kJ/mol,二氧化碳中C=O键的键能为745kJ/mol,设一氧化碳的键能为x,则△H1=2x+497kJ/mol –(745 kJ/mol)![]() -566kJ/mol,所以,x=958.5kJ/mol,则使1molCO(g)完全分解成原子所需要的能量至少为958.5kJ。已知:①2CO(g)+O2(g)=2CO2(g) △H1=-566kJ/mol;②H2O(g)+CO(g)=H2(g)+CO2(g) △H2=-41kJ/mol;③CH3OH(g)+
-566kJ/mol,所以,x=958.5kJ/mol,则使1molCO(g)完全分解成原子所需要的能量至少为958.5kJ。已知:①2CO(g)+O2(g)=2CO2(g) △H1=-566kJ/mol;②H2O(g)+CO(g)=H2(g)+CO2(g) △H2=-41kJ/mol;③CH3OH(g)+![]() O2(g)==CO2(g)+2H2O(g) △H3=-660kJ/mol。根据盖斯定律,由①
O2(g)==CO2(g)+2H2O(g) △H3=-660kJ/mol。根据盖斯定律,由①![]() -②
-②![]() -③可得CO(g)+2H2(g)
-③可得CO(g)+2H2(g)![]() CH3OH(g),则△H4=(-566kJ/mol)
CH3OH(g),则△H4=(-566kJ/mol)![]() -(-41kJ/mol)
-(-41kJ/mol)![]() = -107kJ/mol。
= -107kJ/mol。
(2)①该反应为放热反应,故φ(CH3OH)随温度升高而减小,该反应的平衡常数也随温度的升高而减小,所以,温度T1<T2,K1>K2;若恒温(T1)恒容条件下,起始时a=1、b=2,起始量之比等于化学计量数之比,变化量之比也等于化学计量数之比,则CO和H2的物质的量分数之比也等于化学计量数之比。由图中信息可知,到达平衡状态时,φ(CH3OH)=40%,则φ(CO)=(1-40%)![]() ,φ(H2)= (1-40%)
,φ(H2)= (1-40%)![]() 40%,测得平衡时混合气体的压强为p1kPa,则T1时该反应的压强平衡常数Kp=
40%,测得平衡时混合气体的压强为p1kPa,则T1时该反应的压强平衡常数Kp=![]() (kPa)-2。
(kPa)-2。
②在恒温恒容的平衡体系中再充入与原投料相同的反应物,则平衡向气体分子数减少的方向移动。若恒温恒容条件下,起始时充入1molCO和2molH2,达平衡后,CO的转化率为α1,此时,若再充入1molCO和2molH2,平衡向再次达平衡后,CO的转化率变大,则α1<α2.
③若恒温恒容条件下,起始时a=1、b=2,投料比与化学计量数之比相同,则下列叙述:A.由于变化量之比等于化学计量数之比,故CO、H2的物质的量浓度之比恒为1:2,,无法据此判断是否达到平衡状态,A不正确;B.由于气体的总质量和总体积均不变,故混合气体的密度不随时间的变化而变化,无法根据密度判断是否达到平衡,B不正确;C.混合气体的物质的量是变量,故混合气体的平均摩尔质量也是变量,当其不再随时间的变化而变化时,达到平衡,C正确;D.平衡常数只与温度有关,若将容器改为绝热恒容容器时,平衡常数K不随时间变化而变化时,该反应达到平衡状态,D正确。综上所述,能说明反应达到化学平衡状态的是CD。
(3)已知常温下碳酸的电离常数K1=4.4×10-7、K2=4.7×10-11,则水解常数Kh(HCO3-)=![]() 2.3×10-8>K2,所以,HCO3-的水解程度远远大于其电离程度,其电离可以忽略不计。NH3·H2O的电离常数K=1.8×10-5,则Kh(NH4+)
2.3×10-8>K2,所以,HCO3-的水解程度远远大于其电离程度,其电离可以忽略不计。NH3·H2O的电离常数K=1.8×10-5,则Kh(NH4+)![]() ,所以,NH4+的水解程度小于HCO3-的,则所得到的NH4HCO3溶液中c(NH4+)>c(HCO3-)。
,所以,NH4+的水解程度小于HCO3-的,则所得到的NH4HCO3溶液中c(NH4+)>c(HCO3-)。


科目:高中化学 来源: 题型:
【题目】(1) 合理膳食,保持营养均衡,是青少年学生健康成长的重要保证。
①维生素C能增强人体对疾病的抵抗能力,促进人体生长发育,中学生每天要补充60mg的维生素C。下列物质含有丰富维生素C的是____________(填字母)。
A.牛肉 B.辣椒 C.鸡蛋
②青少年及成人缺乏某种微量元素将导致甲状腺肿大,而且会造成智力损害,该微量元素
是_________( 填字母)
A.碘 B.铁 C.钙
③蛋白质是人体必需的营养物质,它在人体内最终分解为___________(填字母)。
A.葡萄糖 B.氨基酸 C.脂肪酸
(2) 材料是人类生存和发展的物质基础,合理使用材料可以改善我们的生活。
①居室装修所使的人造板材会释放出一种挥发性物质,长期接触会引起过敏性皮炎,免疫功能异常,该挥发性物质是 __________(填字母)。
A.酒精 B.蔗糖 C.甲醛
②玻璃是重要的硅酸盐产品。生产玻璃时,石灰石与石英反应的化学方程式为_________________________________________________________________。
(3) 保持洁净安全的生存环境已成为全人类的共识,人与自然要和谐相处。对汽车加装尾气催化净化装置,可以使其中的NO、CO相互反应转化成无毒的气体,其原理可以用化学方程式表示为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在10mL0.1mol/LNa2CO3溶液中逐滴加入0..1mol/LHCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法不正确的是
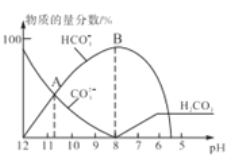
A. 常温下,水解常数Kh(CO32-)的数量级为10-4
B. 当溶液是中性时,溶液的总体积大于20mL
C. 在0.1mol/LNa2CO3溶液中:c(OH-)>c(H2CO3)+c(HCO3-)+c(H+)
D. 在B点所示的溶液中,离子浓度最大的是HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物在耐高温合金工业、催化剂制造、高能燃料等方面有广泛应用。
(1)硼基态原子的电子排布式为_____。硼和铝可分别形成[BF4]-和[AlF6]3-,[BF4]-的空间构型为___,硼元素不可能形成[BF6]3-的原因是________________。
(2)B2H6是一种高能燃料,它与Cl2反应生成的BCl3可用于半导体掺杂工艺及高纯硅制造。由第二周期元素组成的与BCl3互为等电子体的阴离子为________,该阴离子的中心原子杂化方式为_________。
(3)氨硼烷(H3N→BH3)和Ti(BH4)3均为广受关注的新型储氢材料。
①B与N的电负性:B______N(填“>”“<”或“=”,下同)。
②Ti(BH4)3由TiCl3和LiBH4反应制得。写出制备反应的化学方程式:_________。
(4)磷化硼(BP)是受到高度关注的耐磨材料,它可用作金属表面的保护层。如图为磷化硼晶胞。
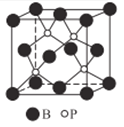
①磷化硼晶体属于______晶体(填晶体类型),是否含有配位键? _____ (填“是”或“否”)
②晶体中P原子的配位数为_____。
③已知BP的晶胞边长为anm,NA为阿伏加德罗常数的数值,则磷化硼晶体的密度为_____g·cm-3(用含a、NA的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O是一种氧气吸收剂,为红棕色晶体。潮湿环境中易被氧化,微溶于乙醇,不溶于水和乙醚(易挥发的有机溶剂,可溶于水)。其制备装置及步骤如下:

①检查装置气密性,往三颈烧瓶中依次加入过量锌粉,200mL0.200mol/LCrC13溶液。
②关闭k2打开k1,旋开分液漏斗的旋塞并控制好滴速。
③待三颈烧瓶內的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,把溶液转移到装置乙中。当出现大量红棕色品体时,关闭分液漏斗的旋塞。
④将装置乙中混合物快速过滤、洗涤和干燥,称量得到5.64g[Cr(CH3COO)2]2·2H2O
(1)装置甲中连通管a的作用是________,如何检验甲装置的气密性是否良好?__________。
(2)三颈烧瓶中的Zn除了与盐酸生成H2外,发生的另一个反应的离子方程式为__________。
(3)步骤③中溶液自动转移至装置乙中的实验操作为________________。
(4)装置丙的作用是________________。
(5)步骤④中进行洗涤的操作方法为________________________________。
(6)洗涤产品时,如何证明产品已经洗涤干净?______________________。
(7)本实验中[Cr(CH3COO)2]2·2H2O (相对分子质量为376)的产率是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由烃A制备抗结肠炎药物H的一种合成路线如下(部分反应略去试剂和条件):

已知:I. ![]()
II. ![]()
回答下列问题:
(1)反应②的类型是_______。
(2)D的结构简式是_______。
(3)G中含有的官能团的名称是_______。
(4)E与足量NaOH溶液反应的化学方程式是_______。
(5)设计C→D和E→F两步反应的共同目的是_______。
(6)化合物X是H的同分异构体,X遇FeCl3溶液不发生显色反应,其核磁共振氢谱显示有3种不同化学环境的氢。峰面积比为3:2:2,写出1种符合要求的X的结构简式_______。
(7)已知![]() 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位。据此写出以A为原料制备化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位。据此写出以A为原料制备化合物![]() 的合成路线_____________________(其他试剂任选)。
的合成路线_____________________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下图中序号①~③仪器的名称:

①_________;② _________;③__________ ;
仪器①~④中,使用时必须检查是否漏水的有 _______.(填仪器序号)
(2)如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.

现用该浓硫酸配制480mL1molL-1的稀硫酸.请回答下列问题:
a. 该硫酸的物质的量浓度为__________molL-1
b.经计算,配制480mL1molL-1的稀硫酸需要用量筒量取上述浓硫酸的体积为_______mL;
c.配制过程中下列各项操作会导致所配稀硫酸浓度偏小的是_____(双选)
A.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水
B.所选用的烧杯、玻璃棒未洗涤
C.定容时,俯视容量瓶刻度线
D.摇匀后静置发现液面低于刻度线,继续滴加蒸馏水至刻度处.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com