
【题目】下列物质属于高分子化合物的是
A.蔗糖B.油脂C.氨基酸D.淀粉
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 实验室用氯化铁溶液制取氢氧化铁胶体:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
B. 碳酸钙溶于醋酸:CaCO3+2H+ ═Ca2++H2O+CO2↑
C. 铝和烧碱溶液:2Al+2OH-+2H2O═2Al3++3H2↑
D. AlCl3溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生活和社会可持续发展关系密切。下列措施正确的是
①将酒精和84消毒液混用,提高杀灭新冠病毒的效果;②研发易降解的生物农药;③应用高效洁净的能源转换技术;④田间焚烧秸秆;⑤推广使用节能环保材料
A.①③⑤B.②③⑤C.①②④D.②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铅可用于铅蓄电池、纤维增重剂、涂料分析试剂。工业上通常用方铅矿(主要成分为PbS)生产硫酸铅。工艺流程如下:

已知:
①25℃,Ksp(PbS)=1.0×10-28,Ksp(PbCl2)=1.6×10-5
②PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
③Fe3+以氢氧化物形式开始沉淀时的pH值为1.9
(1)由于Ksp(PbS)﹤Ksp(PbCl2),PbS+2HCl![]() PbCl2+H2S的反应程度很小,加入FeCl3能增大反应程度,原因是____________________;步骤①反应过程中可观察到有淡黄色固体生成,总反应的离子方程式为_____________________;该步骤需控制溶液的pH<1.9,主要目的是_______________________。
PbCl2+H2S的反应程度很小,加入FeCl3能增大反应程度,原因是____________________;步骤①反应过程中可观察到有淡黄色固体生成,总反应的离子方程式为_____________________;该步骤需控制溶液的pH<1.9,主要目的是_______________________。
(2)步骤②中饱和食盐水的作用是_________________________。
(3)步骤③中滤液A经过蒸发浓缩、用冰水浴冷却结晶后,还需进行的操作是__________(填操作名称)。
(4)步骤④中,若加入稀硫酸充分反应后所得悬浊液中c(Cl-)=1.0mol·L-1,则c(SO42-)=________[Ksp(PbSO4)=1.6×10-8]。步骤⑤中滤液B用适量试剂X处理后可循环利用,试剂X应选用下列中的_____(填标号)。
a.HNO3 b.Cl2 c.H2O2 d.铁粉
(5)炼铅和用铅都会使水体因重金属铅的含量增大而造成严重污染。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-。各形态的铅浓度分数x与溶液pH变化的关系如图所示:

①探究Pb2+的性质:向含Pb2+的溶液中逐滴滴加NaOH溶液后先变浑浊,继续滴加NaOH溶液又变澄清,pH为13~14时,溶液中发生的主要反应的离子方程式为__________________。
②除去溶液中的Pb2+:科研小组用一种新型试剂(DH)“捕捉”金属离子,从而去除水中的痕量铅和其他杂质离子,实验结果记录如下:
离子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ |
处理前浓度/(mg·L-l) | 0.100 | 29.8 | 0.12 | 0.087 |
处理后浓度/(mg· L-1) | 0.004 | 22.6 | 0.04 | 0.053 |
若新型试剂(DH)在脱铅过程中主要发生的反应为:2DH(s)+Pb2+(aq)![]() D2Pb(s)+2H+(aq),则脱铅时最合适的pH约为_____________。该实验中铅的脱除率为_________________。
D2Pb(s)+2H+(aq),则脱铅时最合适的pH约为_____________。该实验中铅的脱除率为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国炼丹家约在唐代或五代时期掌握了以炉甘石点化鍮石(即鍮石金)的技艺:将炉甘石(ZnCO3)、赤铜矿(主要成分Cu2O)和木炭粉混合加热至800℃左右可制得与黄金相似的鍮石金。回答下列问题:
(1)锌元素基态原子的价电子排布式为________________,铜元素基态原子中的未成对电子数为_________________。
(2)硫酸锌溶于过量氨水形成[Zn(NH3)4]SO4溶液。
①[Zn(NH3)4]SO4中,阴离子的立体构型是__________________,[Zn(NH3)4]2+中含有的化学键有__________________。
②NH3分子中,中心原子的轨道杂化类型为________________,NH3在H2O中的溶解度____________(填“大”或“小”),原因是_____________________。
(3)铜的第一电离能为I1Cu=745.5kJ·mol-1,第二电离能为I2Cu=1957.9kJ·mol-1,锌的第一电离能为I1Zn=906.4kJ·mol-1,第二电离能为I2Zn=1733.3kJ·mol-1,I2Cu>I2Zn的原因是___________________。
(4)Cu2O晶体的晶胞结构如图所示。O2-的配位数为_______________;若Cu2O的密度为dg·cm-3,则晶胞参数a=____________nm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的的是
A.只含非金属元素的化合物一定是共价化合物
B.Na2CO3和CaCl2中化学键类型完全相同
C.含有共价键的物质不一定是共价化合物
D.溶于水能导电的化合物一定是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类生存、社会发展不可或缺的物质,CO、H2、CH3OH均是重要的能源物质。
(1)已知:氧气中化学键的键能为497kJ/mol,二氧化碳中C=O键的键能为745kJ/mol。
2CO(g)+O2(g)=2CO2(g) △H1=-566kJ/mol
H2O(g)+CO(g)=H2(g)+CO2(g) △H2=-41kJ/mol
CH3OH(g)+![]() O2(g)==CO2(g)+2H2O(g) △H3=-660kJ/mol
O2(g)==CO2(g)+2H2O(g) △H3=-660kJ/mol
CO(g)+2H2(g)![]() CH3OH(g) △H4
CH3OH(g) △H4
则使1molCO(g)完全分解成原子所需要的能量至少为___,△H4=___。
(2)某密闭容器中存在反应:CO(g)+2H2(g)![]() CH3OH(g),起始时容器中只有amol/LCO和bmol/LH2,平衡时测得混合气体中CH3OH的物质的量分数[φ(CH3OH)]与温度(T)、压强(p)之间的关系如图所示。
CH3OH(g),起始时容器中只有amol/LCO和bmol/LH2,平衡时测得混合气体中CH3OH的物质的量分数[φ(CH3OH)]与温度(T)、压强(p)之间的关系如图所示。
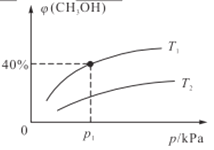
①温度T1和T2时对应的平衡常数分别为K1、K2,则K1____K2(填“>”“<”“=”);若恒温(T1)恒容条件下,起始时a=1、b=2,测得平衡时混合气体的压强为p1kPa,则T1时该反应的压强平衡常数Kp=___。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,用含p1的代数式表示)
②若恒温恒容条件下,起始时充入1molCO和2molH2,达平衡后,CO的转化率为α1,此时,若再充入1molCO和2molH2,再次达平衡后,CO的转化率为α2,则α1_____α2 (填“>”“<”“=”“无法确定”)
③若恒温恒容条件下,起始时a=1、b=2,则下列叙述能说明反应达到化学平衡状态的是____。
A.CO、H2的物质的量浓度之比为1:2,且不再随时间的变化而变化
B.混合气体的密度不再随时间的变化而变化
C.混合气体的平均摩尔质量不再随时间的变化而变化
D.若将容器改为绝热恒容容器时,平衡常数K不随时间变化而变化
(3)工业上常用氨水吸收含碳燃料燃烧中产生的温室气体CO2,其产物之一是NH4HCO3。已知常温下碳酸的电离常数K1=4.4×10-7、K2=4.7×10-11,NH3·H2O的电离常数K=1.8×10-5,则所得到的NH4HCO3溶液中c(NH4+)_____c(HCO3-)(填“>”“<”“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com