
【题目】碳酸钠和碳酸氢钠的混合物190g,加热至质量不再减少为止,称重质量为128g。求原混合物中碳酸钠的质量百分含量? (保留三位有效数字)
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】一种新型熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是 ( )
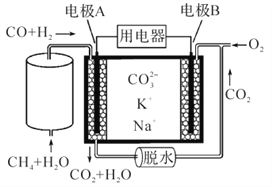
A. 催化重整中CH4+H2O=3H2+CO,1 mol CH4参加反应转移2 mol电子
B. 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C. 电池工作时,CO32-向电极B移动
D. 电极B上的电极反应:O2+2CO2+4e- =2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.5mol/ (NH4)2S溶液中NH4+ 的物质的量浓度_____________。
(2)标准状况下,1.7 g NH3与______L H2S气体含有的氢原子数相同。
(3)标准状况下,1.6g某气态氧化物RO2体积为0.56L,该气体的物质的量为____mol,RO2的相对分子质量为_______。
(4)MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O该反应中的氧化剂是________,若有4molHCl参加反应,则被氧化的HCl的物质的量是______mol,如反应中转移了0.4mol电子,则产生的Cl2在标准状况下体积为_________L。
MnCl2+Cl2↑+2H2O该反应中的氧化剂是________,若有4molHCl参加反应,则被氧化的HCl的物质的量是______mol,如反应中转移了0.4mol电子,则产生的Cl2在标准状况下体积为_________L。
(5)标准状况下,NH3与CH4组成的混合气体的平均密度为0.75g/L,该混合气体的平均摩尔质量为______,该气体对氢气的相对密度为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液滴加到亚硒酸(H2SeO3)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是
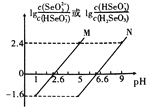
A. Ka1(H2SeO3)的数量级为10-7
B. 曲线M表示pH与lg![]() 的变化关系
的变化关系
C. NaHSeO3溶液中c(OH-)>c(H+)
D. 混合溶液中:lg![]() - lg
- lg![]() =lgKa1(H2SeO3)-lgKa2(H2SeO3)=4
=lgKa1(H2SeO3)-lgKa2(H2SeO3)=4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,22.4L苯所含的碳碳双键数为3NA
B.常温常压下,1mol乙烯所含电子数为12NA
C.1mol金属钠在足量乙醇中完全反应转移的电子数为NA
D.在1L 1mol·L-1的乙酸溶液中含乙酸分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在10mL0.1mol/LNa2CO3溶液中逐滴加入0..1mol/LHCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法不正确的是
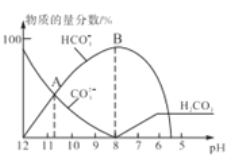
A. 常温下,水解常数Kh(CO32-)的数量级为10-4
B. 当溶液是中性时,溶液的总体积大于20mL
C. 在0.1mol/LNa2CO3溶液中:c(OH-)>c(H2CO3)+c(HCO3-)+c(H+)
D. 在B点所示的溶液中,离子浓度最大的是HCO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com