
【题目】下列反应中必须加入还原剂才能进行的是( )
A.MnO4﹣→Mn2+
B.Cl2→Cl﹣
C.H2→H2O
D.Zn→Zn2+
科目:高中化学 来源: 题型:
【题目】《中国诗词大会》不仅弘扬了中华传统文化,还蕴含着许多化学知识。下列诗句的有关说法错误的是
A. 王安石诗句“雷蟠电掣云滔滔,夜半载雨输亭皋”。雷雨天实现了大气中氮的固定
B. 于谦诗句“凿开混沌得乌金,藏蓄阳和意最深”。“ 乌金”指的是石油
C. 赵孟頫诗句“纷纷灿烂如星陨,霍霍喧逐似火攻”。灿烂的烟花与某些金属元素的焰色反应有关
D. 刘禹锡诗句“千淘万漉虽辛苦,吹尽黄沙始到金”。金性质稳定,存在游离态,可用物理方法获得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国炼丹家约在唐代或五代时期掌握了以炉甘石点化鍮石(即鍮石金)的技艺:将炉甘石(ZnCO3)、赤铜矿(主要成分Cu2O)和木炭粉混合加热至800℃左右可制得与黄金相似的鍮石金。回答下列问题:
(1)锌元素基态原子的价电子排布式为________________,铜元素基态原子中的未成对电子数为_________________。
(2)硫酸锌溶于过量氨水形成[Zn(NH3)4]SO4溶液。
①[Zn(NH3)4]SO4中,阴离子的立体构型是__________________,[Zn(NH3)4]2+中含有的化学键有__________________。
②NH3分子中,中心原子的轨道杂化类型为________________,NH3在H2O中的溶解度____________(填“大”或“小”),原因是_____________________。
(3)铜的第一电离能为I1Cu=745.5kJ·mol-1,第二电离能为I2Cu=1957.9kJ·mol-1,锌的第一电离能为I1Zn=906.4kJ·mol-1,第二电离能为I2Zn=1733.3kJ·mol-1,I2Cu>I2Zn的原因是___________________。
(4)Cu2O晶体的晶胞结构如图所示。O2-的配位数为_______________;若Cu2O的密度为dg·cm-3,则晶胞参数a=____________nm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛。某小组制备亚硝酸钠的实验装置如图所示(部分夹持装置已略去)。
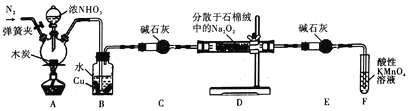
已知:
①2NO+Na2O2=2NaNO2、2NaNO2+O2=2NaNO3
②3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O
③酸性条件下,NO或NO2都能与MnO4-反应生成NO3-和Mn2+
回答下列问题:
(1)反应前需先打开弹簧夹,通入氮气排尽装置中的空气,原因是__________________。
(2)装置A中反应的化学方程式为_________________;装置B中的实验现象为_____________,铜片逐渐溶解并有气泡产生。
(3)若省略装置C,则装置D中的固体产物除NaNO2、NaOH外,还有__________、___________(填化学式)。检验产物中含有NaNO2的方法是:取少量样品于试管中,_____________________,则说明产物中含有NaNO2。
(4)装置E的作用是___________________________。
(5)NaNO2有像食盐一样的咸味,但能引起中毒。已知亚硝酸钠能发生如下反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O。根据上述反应,可以用试剂和生活中常见的物质进行实验,以鉴别亚硝酸钠和食盐。进行实验时,除样品外必须选用的物质有_________(填标号)。
a.白酒 b.碘化钾、淀粉溶液 c.白醋 d.白糖
(6)充分反应后,该小组设计实验检测产物中NaNO2的含量。称取装置D中固体2.3000g,完全溶解配制成溶液l00mL,取出25.00mL溶液用0.100mol·L-1酸性KMnO4溶液进行滴定(杂质不与KMnO4反应),三次滴定平均消耗KMnO4溶液30.00mL,则样品中NaNO2的质量分数为_______________。(已知:NaNO2的摩尔质量为69g·mol-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的的是
A.只含非金属元素的化合物一定是共价化合物
B.Na2CO3和CaCl2中化学键类型完全相同
C.含有共价键的物质不一定是共价化合物
D.溶于水能导电的化合物一定是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粉末状样品A是由等物质的量的MgO和Al2O3与常见金属氧化物B组成的混合物。A有如图所示的转化关系。
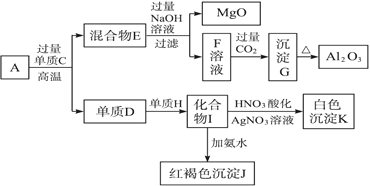
请完成下列问题:
(1) 金属单质C和非金属单质H的化学式分别是__________、_______________
(2) 写出由I生成J的离子方程式:___________________
(3) 写出由F生成G的离子方程式:____________________________
(4) 若10.7 g样品A中MgO、Al2O3和B的物质的量均为0.05 mol,则B的化学式为___________。
(5) 若B中金属原子与氧原子的粒子数之比为2∶3,取7.10 g样品A恰好与含x mol HCl的盐酸完全反应,则x的取值范围是___________(保留小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置,其中试剂b为浓硫酸,则下列实验设计能达到实验目的的是
选项 | 试剂a | 试剂c | 实验目的 |
|
A | MnO2和NaCl | 紫色石蕊溶液 | 验证Cl2的漂白性 | |
B | 蔗糖 | 澄清石灰水 | 验证CO2的生成 | |
C | FeS | 溴水 | 验证非金属性:Br>S | |
D | Na2SO3 | 品红溶液 | 验证SO2的漂白性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳的氧化物和氮的氧化物与人类生活息息相关,它们之间有多种相互转化关系,可以变废为宝。
(1)为了模拟汽车尾气在催化转化器内的工作反应情况,控制定条件,让反应在恒容密闭容器中进行如下反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g),用传感器测得不同时间NO和CO的依度如下表:
N2(g)+2CO2(g),用传感器测得不同时间NO和CO的依度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)(10-4mol/L) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(NO)(10-3mol/L) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①前2s内的平均反应速率v(N2)=________,此温度下,该反应的平衡常数K=_______
②能说明上述反应达到平衡状态的是____________。
A.2n(CO2)=n(N2) B.混合气体的平均相对分子质量不变
C.气体密度不变 D.容器内气体压强不变
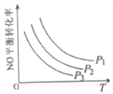
③当NO与CO浓度相等时,体系中NO的平衡转化率与温度、压强的关系如图所示。则NO的平衡转化率随温度升高而减小的原因是___,压强P1、P2、P3的大小关系是____________,理由是_______________________。
(2)用氨气催化氧化还原法脱硝(NOx)
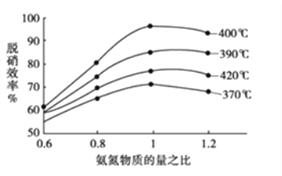
①根据下图判断提高脱硝效率(单位时间内NOx浓度变化占烟气初始浓度的百分比)的最佳条件是:______________________。
②已知:N2(g)+O2(g)=2NO(g) △H=+akJ/mol
N2(g)+3H2(g)![]() 2NH3(g) △H=-bk/mol
2NH3(g) △H=-bk/mol
2H2(g)+O2(g)=2H2O(g) △H=-ckJ/mol 其中a、b、C均为大于0。
则放热反应:4NO(g)+4NH3(g)+O2(g)![]() 4N2(g)+6H2O(g) △H=____________。
4N2(g)+6H2O(g) △H=____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com