
【题目】碳的氧化物和氮的氧化物与人类生活息息相关,它们之间有多种相互转化关系,可以变废为宝。
(1)为了模拟汽车尾气在催化转化器内的工作反应情况,控制定条件,让反应在恒容密闭容器中进行如下反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g),用传感器测得不同时间NO和CO的依度如下表:
N2(g)+2CO2(g),用传感器测得不同时间NO和CO的依度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)(10-4mol/L) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(NO)(10-3mol/L) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①前2s内的平均反应速率v(N2)=________,此温度下,该反应的平衡常数K=_______
②能说明上述反应达到平衡状态的是____________。
A.2n(CO2)=n(N2) B.混合气体的平均相对分子质量不变
C.气体密度不变 D.容器内气体压强不变
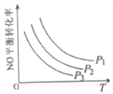
③当NO与CO浓度相等时,体系中NO的平衡转化率与温度、压强的关系如图所示。则NO的平衡转化率随温度升高而减小的原因是___,压强P1、P2、P3的大小关系是____________,理由是_______________________。
(2)用氨气催化氧化还原法脱硝(NOx)
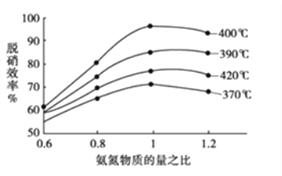
①根据下图判断提高脱硝效率(单位时间内NOx浓度变化占烟气初始浓度的百分比)的最佳条件是:______________________。
②已知:N2(g)+O2(g)=2NO(g) △H=+akJ/mol
N2(g)+3H2(g)![]() 2NH3(g) △H=-bk/mol
2NH3(g) △H=-bk/mol
2H2(g)+O2(g)=2H2O(g) △H=-ckJ/mol 其中a、b、C均为大于0。
则放热反应:4NO(g)+4NH3(g)+O2(g)![]() 4N2(g)+6H2O(g) △H=____________。
4N2(g)+6H2O(g) △H=____________。
【答案】 1.875×10-4mol·L-1·s-1 5000L/mol BD 该反应正反应放热,升高温度,平衡逆向移动,NO的平衡转化率减小 P1>P2>P3 正反应为体积减小的反应,增压平衡正向移动,NO的衡转化率增大 400℃、氨氮物质的量之比为1 -(2a-2b+3c)或2b-2a-3c kJ/mol
【解析】试题分析:(1)①前2s内NO的浓度变化是7.5×10-4mol·L-1,则N2的浓度变化是3.75×10-4mol·L-1,根据![]() 计算速率;根据表格数据,反应在4s时达到平衡状态,根据K=
计算速率;根据表格数据,反应在4s时达到平衡状态,根据K=![]() 计算 。②根据平衡标志分析;③NO的平衡转化率随温度升高而减小,说明升高温度平衡逆向移动,正反应放热;正反应为体积减小的反应,增压平衡正向移动;(2) ①根据图像,400℃、氨氮物质的量之比为1时,脱硝效率最高;②根据盖斯定律计算4NO(g)+4NH3(g)+O2(g)
计算 。②根据平衡标志分析;③NO的平衡转化率随温度升高而减小,说明升高温度平衡逆向移动,正反应放热;正反应为体积减小的反应,增压平衡正向移动;(2) ①根据图像,400℃、氨氮物质的量之比为1时,脱硝效率最高;②根据盖斯定律计算4NO(g)+4NH3(g)+O2(g)![]() 4N2(g)+6H2O(g)的△H;
4N2(g)+6H2O(g)的△H;
解析:(1) ①前2s内NO的浓度变化是7.5×10-4mol·L-1,则N2的浓度变化是3.75×10-4mol·L-1, ![]() 1.875×10-4mol·L-1·s-1;
1.875×10-4mol·L-1·s-1;
根据表格数据,反应在4s时达到平衡状态

K=![]() 5000L/mol;
5000L/mol;
② 2n(CO2)=n(N2),都是指正反应方向,所以不一定平衡,故A错误;根据![]() ,混合气体的平均相对分子质量是变量,所以混合气体的平均相对分子质量不变,一定达到平衡状态,故B正确;根据
,混合气体的平均相对分子质量是变量,所以混合气体的平均相对分子质量不变,一定达到平衡状态,故B正确;根据![]() ,气体密度是恒量,气体密度不变,不一定达到平衡状态,故C错误;反应前后气体物质的量是变量,压强是变量,所以容器内气体压强不变,一定达到平衡状态,故D正确。③正反应放热,升高温度平衡逆向移动,所以NO的平衡转化率随温度升高而减小;正反应为体积减小的反应,增压平衡正向移动,NO转化率越大,说明压强越大,所以压强P1>P2>P3;(2) ①根据图像,400℃、氨氮物质的量之比为1时,脱硝效率最高,所以脱硝的最佳条件是400℃、氨氮物质的量之比为1;② Ⅰ、N2(g)+O2(g)=2NO(g) △H=+akJ/mol
,气体密度是恒量,气体密度不变,不一定达到平衡状态,故C错误;反应前后气体物质的量是变量,压强是变量,所以容器内气体压强不变,一定达到平衡状态,故D正确。③正反应放热,升高温度平衡逆向移动,所以NO的平衡转化率随温度升高而减小;正反应为体积减小的反应,增压平衡正向移动,NO转化率越大,说明压强越大,所以压强P1>P2>P3;(2) ①根据图像,400℃、氨氮物质的量之比为1时,脱硝效率最高,所以脱硝的最佳条件是400℃、氨氮物质的量之比为1;② Ⅰ、N2(g)+O2(g)=2NO(g) △H=+akJ/mol
Ⅱ、N2(g)+3H2(g)![]() 2NH3(g) △H=-bk/mol
2NH3(g) △H=-bk/mol
Ⅲ、2H2(g)+O2(g)=2H2O(g) △H=-ckJ/mol
根据盖斯定律Ⅲ![]() Ⅰ
Ⅰ![]() Ⅱ
Ⅱ![]() 得4NO(g)+4NH3(g)+O2(g)
得4NO(g)+4NH3(g)+O2(g)![]() 4N2(g)+6H2O(g) △H=2b-2a-3c kJ/mol;
4N2(g)+6H2O(g) △H=2b-2a-3c kJ/mol;


科目:高中化学 来源: 题型:
【题目】常温下,在10mL0.1mol/LNa2CO3溶液中逐滴加入0..1mol/LHCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法不正确的是
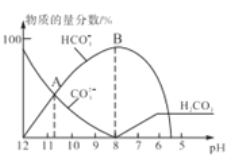
A. 常温下,水解常数Kh(CO32-)的数量级为10-4
B. 当溶液是中性时,溶液的总体积大于20mL
C. 在0.1mol/LNa2CO3溶液中:c(OH-)>c(H2CO3)+c(HCO3-)+c(H+)
D. 在B点所示的溶液中,离子浓度最大的是HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O是一种氧气吸收剂,为红棕色晶体。潮湿环境中易被氧化,微溶于乙醇,不溶于水和乙醚(易挥发的有机溶剂,可溶于水)。其制备装置及步骤如下:

①检查装置气密性,往三颈烧瓶中依次加入过量锌粉,200mL0.200mol/LCrC13溶液。
②关闭k2打开k1,旋开分液漏斗的旋塞并控制好滴速。
③待三颈烧瓶內的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,把溶液转移到装置乙中。当出现大量红棕色品体时,关闭分液漏斗的旋塞。
④将装置乙中混合物快速过滤、洗涤和干燥,称量得到5.64g[Cr(CH3COO)2]2·2H2O
(1)装置甲中连通管a的作用是________,如何检验甲装置的气密性是否良好?__________。
(2)三颈烧瓶中的Zn除了与盐酸生成H2外,发生的另一个反应的离子方程式为__________。
(3)步骤③中溶液自动转移至装置乙中的实验操作为________________。
(4)装置丙的作用是________________。
(5)步骤④中进行洗涤的操作方法为________________________________。
(6)洗涤产品时,如何证明产品已经洗涤干净?______________________。
(7)本实验中[Cr(CH3COO)2]2·2H2O (相对分子质量为376)的产率是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案能达到目的的是( )
A. 用品红溶液检验SO2
B. 用焰色反应鉴别KNO3和KCl
C. 用澄清石灰水鉴别MgCl2溶液和NaHCO3溶液
D. 用丁达尔效应区分FeCl3溶液和Fe2(SO4)3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由烃A制备抗结肠炎药物H的一种合成路线如下(部分反应略去试剂和条件):

已知:I. ![]()
II. ![]()
回答下列问题:
(1)反应②的类型是_______。
(2)D的结构简式是_______。
(3)G中含有的官能团的名称是_______。
(4)E与足量NaOH溶液反应的化学方程式是_______。
(5)设计C→D和E→F两步反应的共同目的是_______。
(6)化合物X是H的同分异构体,X遇FeCl3溶液不发生显色反应,其核磁共振氢谱显示有3种不同化学环境的氢。峰面积比为3:2:2,写出1种符合要求的X的结构简式_______。
(7)已知![]() 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位。据此写出以A为原料制备化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位。据此写出以A为原料制备化合物![]() 的合成路线_____________________(其他试剂任选)。
的合成路线_____________________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X、Y、Z的分子式均为C7H8,结构简式如图。下列说法正确的是
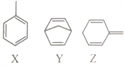
A. X、Y、Z分子中碳原子均能处在同一平面上
B. X、Y、Z三种有机物均能使酸性高锰酸钾溶液褪色
C. 1molX与Z的混合物中含有3mol碳碳双键
D. Y的一氯代物有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为了探究NaClO溶液的性质,设计了下列实验,并记录实验现象。
实验装置 | 实验序号 | 滴管试剂 | 试管试剂 | 实验现象 |
| ① | 0.2 mol/L NaClO溶液 | 饱和Ag2SO4溶液 | 产生白色沉淀 |
② | CH3COOH溶液 | 光照管壁有无色气泡 | ||
③ | 0.2mol/LFeSO4酸性溶液和KSCN溶液 | 溶液变红 | ||
④ | 0.2mol/L的AlCl3溶液 | 产生白色沉淀 |
则以下判断不正确的是
A. 实验①:发生的反应为Ag++ClO-+H2O=AgCl↓+2OH- B. 实验②:无色气体为O2
C. 实验③:还原性强弱顺序Fe2+>Cl- D. 实验④:ClO-与Al3+的水解相互促进
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com