
【题目】由烃A制备抗结肠炎药物H的一种合成路线如下(部分反应略去试剂和条件):

已知:I. ![]()
II. ![]()
回答下列问题:
(1)反应②的类型是_______。
(2)D的结构简式是_______。
(3)G中含有的官能团的名称是_______。
(4)E与足量NaOH溶液反应的化学方程式是_______。
(5)设计C→D和E→F两步反应的共同目的是_______。
(6)化合物X是H的同分异构体,X遇FeCl3溶液不发生显色反应,其核磁共振氢谱显示有3种不同化学环境的氢。峰面积比为3:2:2,写出1种符合要求的X的结构简式_______。
(7)已知![]() 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位。据此写出以A为原料制备化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位。据此写出以A为原料制备化合物![]() 的合成路线_____________________(其他试剂任选)。
的合成路线_____________________(其他试剂任选)。
【答案】 取代反应 ![]() 羧基、羟基、硝基
羧基、羟基、硝基 ![]() 保护酚羟基(防止酚羟基被氧化)
保护酚羟基(防止酚羟基被氧化) ![]() 或
或![]()
![]()
【解析】试题分析:烃A![]() B
B![]()
![]() ,结合D的结构简式,逆推A是甲苯,B是
,结合D的结构简式,逆推A是甲苯,B是![]() ,C是
,C是![]() ,根据
,根据![]() ,
,![]()
![]() D,则D是
D,则D是![]() ,
,![]() 氧化为
氧化为![]() ;
;![]() 在氢氧化钠溶液中水解,酸化后生成F,则F是
在氢氧化钠溶液中水解,酸化后生成F,则F是![]() ,根据
,根据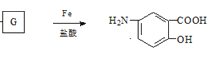 ,逆推G是
,逆推G是![]() ;
; ![]() 与浓硫酸、浓硝酸发生消化反应生成
与浓硫酸、浓硝酸发生消化反应生成![]() ;
;
解析:根据以上分析,(1) 反应②是![]() 与浓硫酸、浓硝酸发生消化反应生成
与浓硫酸、浓硝酸发生消化反应生成![]() ,反应②的类型是取代反应。 (2)D的结构简式是
,反应②的类型是取代反应。 (2)D的结构简式是![]() 。 (3)G是
。 (3)G是![]() ,含有的官能团的名称是硝基、羧基、羟基。 (4)
,含有的官能团的名称是硝基、羧基、羟基。 (4) ![]() 与足量NaOH溶液发生水解反应,反应的化学方程式是
与足量NaOH溶液发生水解反应,反应的化学方程式是![]() 。 (5)设计C→D和E→F两步反应的共同目的是防止酚羟基被氧化。 (6)化合物X是
。 (5)设计C→D和E→F两步反应的共同目的是防止酚羟基被氧化。 (6)化合物X是![]() 的同分异构体,X遇FeCl3溶液不发生显色反应,说明不含酚羟基,其核磁共振氢谱显示有3种不同化学环境的氢。峰面积比为3:2:2,写出1种符合要求的X的结构简式
的同分异构体,X遇FeCl3溶液不发生显色反应,说明不含酚羟基,其核磁共振氢谱显示有3种不同化学环境的氢。峰面积比为3:2:2,写出1种符合要求的X的结构简式![]() 或
或![]() 。
。
(7)根据 ![]() 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位。以甲苯为原料制备化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位。以甲苯为原料制备化合物![]() 时,甲苯先发生硝化反应,生成邻硝基甲苯,再用高锰酸钾溶液氧化为邻硝基苯甲酸,最后把硝基还原为氨基,合成路线为
时,甲苯先发生硝化反应,生成邻硝基甲苯,再用高锰酸钾溶液氧化为邻硝基苯甲酸,最后把硝基还原为氨基,合成路线为![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的的是
A.只含非金属元素的化合物一定是共价化合物
B.Na2CO3和CaCl2中化学键类型完全相同
C.含有共价键的物质不一定是共价化合物
D.溶于水能导电的化合物一定是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类生存、社会发展不可或缺的物质,CO、H2、CH3OH均是重要的能源物质。
(1)已知:氧气中化学键的键能为497kJ/mol,二氧化碳中C=O键的键能为745kJ/mol。
2CO(g)+O2(g)=2CO2(g) △H1=-566kJ/mol
H2O(g)+CO(g)=H2(g)+CO2(g) △H2=-41kJ/mol
CH3OH(g)+![]() O2(g)==CO2(g)+2H2O(g) △H3=-660kJ/mol
O2(g)==CO2(g)+2H2O(g) △H3=-660kJ/mol
CO(g)+2H2(g)![]() CH3OH(g) △H4
CH3OH(g) △H4
则使1molCO(g)完全分解成原子所需要的能量至少为___,△H4=___。
(2)某密闭容器中存在反应:CO(g)+2H2(g)![]() CH3OH(g),起始时容器中只有amol/LCO和bmol/LH2,平衡时测得混合气体中CH3OH的物质的量分数[φ(CH3OH)]与温度(T)、压强(p)之间的关系如图所示。
CH3OH(g),起始时容器中只有amol/LCO和bmol/LH2,平衡时测得混合气体中CH3OH的物质的量分数[φ(CH3OH)]与温度(T)、压强(p)之间的关系如图所示。
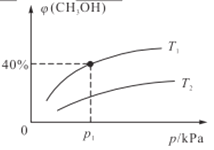
①温度T1和T2时对应的平衡常数分别为K1、K2,则K1____K2(填“>”“<”“=”);若恒温(T1)恒容条件下,起始时a=1、b=2,测得平衡时混合气体的压强为p1kPa,则T1时该反应的压强平衡常数Kp=___。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,用含p1的代数式表示)
②若恒温恒容条件下,起始时充入1molCO和2molH2,达平衡后,CO的转化率为α1,此时,若再充入1molCO和2molH2,再次达平衡后,CO的转化率为α2,则α1_____α2 (填“>”“<”“=”“无法确定”)
③若恒温恒容条件下,起始时a=1、b=2,则下列叙述能说明反应达到化学平衡状态的是____。
A.CO、H2的物质的量浓度之比为1:2,且不再随时间的变化而变化
B.混合气体的密度不再随时间的变化而变化
C.混合气体的平均摩尔质量不再随时间的变化而变化
D.若将容器改为绝热恒容容器时,平衡常数K不随时间变化而变化
(3)工业上常用氨水吸收含碳燃料燃烧中产生的温室气体CO2,其产物之一是NH4HCO3。已知常温下碳酸的电离常数K1=4.4×10-7、K2=4.7×10-11,NH3·H2O的电离常数K=1.8×10-5,则所得到的NH4HCO3溶液中c(NH4+)_____c(HCO3-)(填“>”“<”“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在水溶液中1 mol Cl-、ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是

A. a、b、c、d、e中,c最稳定
B. b→a+c反应的活化能为反应物能量减生成物能量
C. b→a+d反应的热化学方程式为:3ClO-(aq)=ClO3-(aq)+2Cl-(aq)ΔH=+116 kJ·mol-1
D. 一定温度下,Cl2与NaOH溶液反应生成的产物有a、b、d,溶液中a、b、d的浓度之比可能为11∶1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳的氧化物和氮的氧化物与人类生活息息相关,它们之间有多种相互转化关系,可以变废为宝。
(1)为了模拟汽车尾气在催化转化器内的工作反应情况,控制定条件,让反应在恒容密闭容器中进行如下反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g),用传感器测得不同时间NO和CO的依度如下表:
N2(g)+2CO2(g),用传感器测得不同时间NO和CO的依度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)(10-4mol/L) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(NO)(10-3mol/L) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①前2s内的平均反应速率v(N2)=________,此温度下,该反应的平衡常数K=_______
②能说明上述反应达到平衡状态的是____________。
A.2n(CO2)=n(N2) B.混合气体的平均相对分子质量不变
C.气体密度不变 D.容器内气体压强不变
③当NO与CO浓度相等时,体系中NO的平衡转化率与温度、压强的关系如图所示。则NO的平衡转化率随温度升高而减小的原因是___,压强P1、P2、P3的大小关系是____________,理由是_______________________。
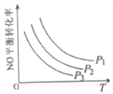
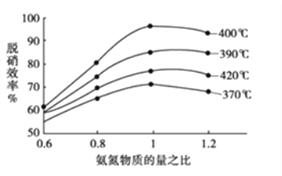
(2)用氨气催化氧化还原法脱硝(NOx)
①根据下图判断提高脱硝效率(单位时间内NOx浓度变化占烟气初始浓度的百分比)的最佳条件是:______________________。
②已知:N2(g)+O2(g)=2NO(g) △H=+akJ/mol
N2(g)+3H2(g)![]() 2NH3(g) △H=-bk/mol
2NH3(g) △H=-bk/mol
2H2(g)+O2(g)=2H2O(g) △H=-ckJ/mol 其中a、b、C均为大于0。
则放热反应:4NO(g)+4NH3(g)+O2(g)![]() 4N2(g)+6H2O(g) △H=____________。
4N2(g)+6H2O(g) △H=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)实验室用加热二氧化锰和浓盐酸制氯气,离子方程式为____________________。若生成标准状况下2.24 L Cl2,则被氧化的HCl的物质的量为 _______________。
(2)向淀粉碘化钾溶液中通入少量氯气,立即会看到溶液变蓝色,反应的离子方程式为_______________________________________。
(3)①乙醇 ②MgCl2晶体 ③蔗糖 ④铜 ⑤食盐水 ⑥BaSO4 ⑦次氯酸
以上物质中属于电解质的是(填序号)_____________________________________。
(4)在甲、乙两个烧杯中,分别含有下列离子中的三种:Cu2+、Na+、H+、SO42-、CO32-、OH-。已知甲烧杯中的溶液呈蓝色,则乙烧杯中的溶液中大量存在的离子是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同pH值得盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如图所示。据图判断不正确的是

A. I为盐酸稀释时的pH值变化曲线
B. b点溶液的导电性比c点溶液的导电性强
C. a点KW的数值比c点KW的数值大
D. a点酸的总浓度大于b点酸的总浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z在周期表中的位置如下图所示,则下列说法中错误的是
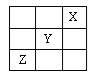
A. X元素的最外层电子数为2
B. Y的气态氢化物的化学式为HY
C. Z的最高价氧化物的化学式为ZO2
D. X、Y、Z的单质中X单质最稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com