
����Ŀ��һ�������£���ˮ��Һ��1 mol Cl����ClOx��(x��1��2��3��4)������(kJ)��Դ�С��ͼ��ʾ�������й�˵����ȷ����

A. a��b��c��d��e�У�c���ȶ�
B. b��a��c��Ӧ�Ļ��Ϊ��Ӧ������������������
C. b��a��d��Ӧ���Ȼ�ѧ����ʽΪ��3ClO��(aq)��ClO3��(aq)��2Cl��(aq)��H����116 kJ��mol��1
D. һ���¶��£�Cl2��NaOH��Һ��Ӧ���ɵIJ�����a��b��d����Һ��a��b��d��Ũ��֮�ȿ���Ϊ11��1��2
���𰸡�D
��������������Ԫ�صĻ��ϼۣ�a��b��c��d��e���δ���Cl-��ClO-��ClO2-��ClO3-��ClO4-��A���������Խ��Խ�ȶ�����ͼ�ɵ�a��b��c��d��e�У�a���ȶ���c��ȶ�����A����B���Ӧ������-����������=-��H������ͼ���������ж�b��a+c��Ӧ�Ļ�ܣ���B����C�aΪCl-��bΪClO-��dΪClO3-��B��A+D�Ļ�ѧ����ʽΪ3ClO-=ClO3-+2Cl-����������ṩ�����ݣ���Ӧ��Ϊ����H=64kJmol-1+2��0kJmol-1-3��60kJmol-1=-116kJmol-1����C������D�������ԭ��Ӧ��ѭ�����غ���Cl2��NaOH��Һ��Ӧ���ɵIJ�����a(Cl-)��b(ClO-)��d(ClO3-)����Ԫ�ػ��ϼ���0�۽�Ϊ-1�ۡ���Ϊ+1�ۺ�+5�ۣ��ɵ����غ�ã�n(Cl-)=n(ClO-)+5n(ClO3-)������Һ��a��b��d��Ũ��֮��Ϊ11��1��2ʱ���������غ�ʽ��������D��ȷ��


 ����������ϵ�д�
����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������(��)���Ҷ�ȩ������ȩ���ǻ���ԭ�ϣ�ijС����Ƶĺϳ�·�����£�
��֪��
��2R-Br+2Na![]() R-R+2NaBr
R-R+2NaBr
��B�ĺ˴Ź�������ֻ��1�����շ�
��![]()
��![]()
�ش��������⣺
(1)A�Ļ�ѧ����Ϊ_____________�� D�Ľṹ��ʽΪ__________________��I�ķ���ʽΪ__________________��
(2)B��C�Ļ�ѧ����ʽ_________________��E��F�Ļ�ѧ����ʽΪ_______________���÷�Ӧ����Ϊ________________��
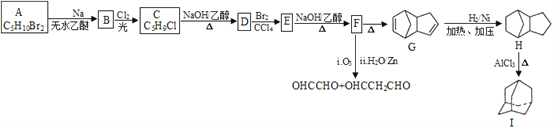
(3)G�ķ�����ͬ���칹���У������ϵ�ȡ������ĿС��3����ʹ������Ȼ�̼��Һ��ɫ�Ĺ���_______��(���������칹)�����к˴Ź���������5��壬�ҷ������Ϊ6��2��2��1��1����_________________(д�ṹ��ʽ)��
(4)д���û����ϩ����ϩΪԭ���Ʊ�������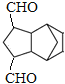 �ĺϳ�·��____________(�����Լ���ѡ)��
�ĺϳ�·��____________(�����Լ���ѡ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�� ������ʳ������Ӫ�����⣬��������ѧ�������ɳ�����Ҫ��֤��
��ά����C����ǿ����Լ����ĵֿ��������ٽ�����������������ѧ��ÿ��Ҫ����60mg��ά����C���������ʺ��зḻά����C����____________������ĸ����
A��ţ�� B������ C������
�������꼰����ȱ��ij����Ԫ�ؽ����¼�״���״��һ��������������Ԫ��
��_________�� ����ĸ��
A���� B���� C����
�۵���������������Ӫ�����ʣ��������������շֽ�Ϊ___________������ĸ����
A�������� B�������� C��֬����
��2�� ��������������ͷ�չ�����ʻ���������ʹ�ò��Ͽ��Ը������ǵ����
�پ���װ����ʹ�������Ļ��ͷų�һ�ֻӷ������ʣ����ڽӴ������������Ƥ�ף����߹����쳣���ûӷ��������� __________������ĸ����
A���ƾ� B������ C����ȩ
�ڲ�������Ҫ�Ĺ����β�Ʒ����������ʱ��ʯ��ʯ��ʯӢ��Ӧ�Ļ�ѧ����ʽΪ_________________________________________________________________��
��3�� ���ֽྻ��ȫ�����滷���ѳ�Ϊȫ����Ĺ�ʶ��������ȻҪ��г�ദ����������װβ��������װ�ã�����ʹ���е�NO��CO���Ӧת�����������壬��ԭ�������û�ѧ����ʽ��ʾΪ____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����仯���������ºϽ�ҵ���������졢����ȼ�ϵȷ����й㷺Ӧ�á�
��1�����̬ԭ�ӵĵ����Ų�ʽΪ_____��������ɷֱ��γ�[BF4]-��[AlF6]3-��[BF4]-�Ŀռ乹��Ϊ___����Ԫ�ز������γ�[BF6]3-��ԭ����________________��
��2��B2H6��һ�ָ���ȼ�ϣ�����Cl2��Ӧ���ɵ�BCl3�����ڰ뵼����ӹ��ռ��ߴ������졣�ɵڶ�����Ԫ����ɵ���BCl3��Ϊ�ȵ������������Ϊ________���������ӵ�����ԭ���ӻ���ʽΪ_________��
��3��������(H3N��BH3)��Ti(BH4)3��Ϊ���ܹ�ע�����ʹ�����ϡ�
��B��N�ĵ縺��:B______N(��������������������������ͬ)��
��Ti(BH4)3��TiCl3��LiBH4��Ӧ�Ƶá�д���Ʊ���Ӧ�Ļ�ѧ����ʽ:_________��
��4������(BP)���ܵ��߶ȹ�ע����ĥ���ϣ�����������������ı����㡣��ͼΪ������
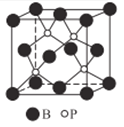
������������______����(�������)���Ƿ�����λ��? _____ (����������������)
�ھ�����Pԭ�ӵ���λ��Ϊ_____��
����֪BP�ľ����߳�Ϊanm��NAΪ�����ӵ���������ֵ������������ܶ�Ϊ_____g��cm-3(�ú�a��NA��ʽ�ӱ�ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ǹ�ˮ����[Cr(CH3COO)2]2��2H2O��һ���������ռ���Ϊ����ɫ���塣��ʪ�������ױ������������Ҵ�,������ˮ������(�ӷ����л��ܼ���������ˮ)�����Ʊ�װ�ü���������:

�ټ��װ��������,��������ƿ�����μ������п�ۣ�200mL0.200mol/LCrC13��Һ��
�ڹر�k2��k1,������Һ©�������������ƺõ��١�
�۴�������ƿ�ȵ���Һ������ɫ(Cr3+)��Ϊ����ɫ(Cr2+)ʱ������Һת�Ƶ�װ�����С������ִ�������ɫƷ��ʱ���رշ�Һ©����������
�ܽ�װ�����л������ٹ��ˡ�ϴ�Ӻ�������õ�5.64g[Cr(CH3COO)2]2��2H2O
��1��װ�ü�����ͨ��a��������________����μ����װ�õ��������Ƿ�����?__________��
��2��������ƿ�е�Zn��������������H2�⣬��������һ����Ӧ�����ӷ���ʽΪ__________��
��3�����������Һ�Զ�ת����װ�����е�ʵ�����Ϊ________________��
��4��װ�ñ���������________________��
��5��������н���ϴ�ӵIJ�������Ϊ________________________________��
��6��ϴ�Ӳ�Ʒʱ�����֤����Ʒ�Ѿ�ϴ�Ӹɾ�?______________________��
��7����ʵ����[Cr(CH3COO)2]2��2H2O (��Է�������Ϊ376)�IJ�����___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ�������
A.�ñ���ȡ��ˮ�еĵ⣬���Һ��ˮ����Ͽڵ���
B.���������ﶼ�Ǽ���������
C.���Ȼ�����Һ��������������Һ���Ʊ�������������
D.������Ͳȷ��ȡ9.5mLˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������A�Ʊ����᳦��ҩ��H��һ�ֺϳ�·������(���ַ�Ӧ��ȥ�Լ�������):

��֪��I. ![]()
II. ![]()
�ش���������:
(1)��Ӧ�ڵ�������_______��
(2)D�Ľṹ��ʽ��_______��
(3)G�к��еĹ����ŵ�������_______��
(4)E������NaOH��Һ��Ӧ�Ļ�ѧ����ʽ��_______��
(5)���C��D��E��F������Ӧ�Ĺ�ͬĿ����_______��
(6)������X��H��ͬ���칹�壬X��FeCl3��Һ��������ɫ��Ӧ����˴Ź���������ʾ��3�ֲ�ͬ��ѧ�������⡣�������Ϊ3:2:2��д��1�ַ���Ҫ���X�Ľṹ��ʽ_______��
(7)��֪![]() �ױ��������������������ʱ������һ��ȡ��������ȡ����������ڶ�λ�����������������Ȼ�ʱ��ȡ���ڼ�λ���ݴ�д����AΪԭ���Ʊ�������
�ױ��������������������ʱ������һ��ȡ��������ȡ����������ڶ�λ�����������������Ȼ�ʱ��ȡ���ڼ�λ���ݴ�д����AΪԭ���Ʊ�������![]() �ĺϳ�·��_____________________(�����Լ���ѡ)��
�ĺϳ�·��_____________________(�����Լ���ѡ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪������CH3COOH��NH3��H2O�ĵ��볣����ȣ�����10mLŨ��Ϊ0.01mol/L�İ�ˮ��Һ�еμ���ͬŨ�ȵ�CH3COOH��Һ���ڵμӹ�������Һ��pH�����Ӵ���������ϵ��ͼ��ʾ������˵���������

A. n=7
B. ˮ�ĵ���̶��������ټ�С
C. �����£�0.01mol/L�İ�ˮ��Һ��NH3��H2O�ĵ����Ϊ3.98%
D. Y����Һ��c(NH3��H2O)+(OH-)=c(CH3COO-)+c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����е��뷽��ʽ����д��ȷ���ǣ�������
A. NaHSO4![]() Na++H++SO42�� B. NaHCO3
Na++H++SO42�� B. NaHCO3![]() Na++H++CO32��
Na++H++CO32��
C. HClO=H++ClO�� D. MgCl2�TMg2++2Cl��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com