
【题目】按要求填空:
(1)实验室用加热二氧化锰和浓盐酸制氯气,离子方程式为____________________。若生成标准状况下2.24 L Cl2,则被氧化的HCl的物质的量为 _______________。
(2)向淀粉碘化钾溶液中通入少量氯气,立即会看到溶液变蓝色,反应的离子方程式为_______________________________________。
(3)①乙醇 ②MgCl2晶体 ③蔗糖 ④铜 ⑤食盐水 ⑥BaSO4 ⑦次氯酸
以上物质中属于电解质的是(填序号)_____________________________________。
(4)在甲、乙两个烧杯中,分别含有下列离子中的三种:Cu2+、Na+、H+、SO42-、CO32-、OH-。已知甲烧杯中的溶液呈蓝色,则乙烧杯中的溶液中大量存在的离子是_____________________。
【答案】MnO2+4H+ +2Cl-![]() Mn2+ +Cl2↑+2H2O 0.2mol Cl2+2I=2Cl+I2 ②⑥⑦ Na+、CO32-、OH-
Mn2+ +Cl2↑+2H2O 0.2mol Cl2+2I=2Cl+I2 ②⑥⑦ Na+、CO32-、OH-
【解析】
(1)实验室用加热二氧化锰和浓盐酸制氯气,离子方程式为:MnO2+4H+ +2Cl-![]() Mn2+ +Cl2↑+2H2O;生成标准状况下2.24 L Cl2,即0.1molCl2,则被氧化的HCl的物质的量为0.2mol;
Mn2+ +Cl2↑+2H2O;生成标准状况下2.24 L Cl2,即0.1molCl2,则被氧化的HCl的物质的量为0.2mol;
(2)向淀粉碘化钾溶液中通入少量氯气,立即会看到溶液变蓝色,说明有I2生成,故反应的离子方程式为:Cl2+2I=2Cl+I2;
(3)电解质:在水溶液或熔融状态下能发生电离的化合物。由此可知,属于电解质的是:②⑥⑦;
(4)甲烧杯中的溶液呈蓝色,说明甲烧杯中含有Cu2+,因Cu2+与CO32-、OH-不能大量共存,故溶液中的阴离子为SO42-,故乙烧杯中的溶液中大量存在的离子是Na+、CO32-、OH-。


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH溶液分别滴定浓度均为0.10mol·L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示。下列判断不正确的是
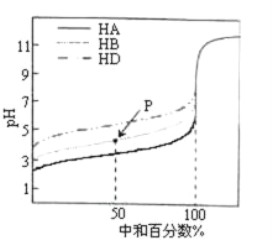
A. 三种酸的电离平衡常数:K(HA)>K(HB)>K(HD)
B. 滴定至M点时,溶液中:c(B-)>c(Na+)>c(HB)>cH+)>c(OH-)
C. pH=7时,三种溶液中:c(A-)>c(B-)>c(D-)
D. 当中和百分数达到100%时,三种溶液中:c(HA)>c(HB)>c(HD)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物在耐高温合金工业、催化剂制造、高能燃料等方面有广泛应用。
(1)硼基态原子的电子排布式为_____。硼和铝可分别形成[BF4]-和[AlF6]3-,[BF4]-的空间构型为___,硼元素不可能形成[BF6]3-的原因是________________。
(2)B2H6是一种高能燃料,它与Cl2反应生成的BCl3可用于半导体掺杂工艺及高纯硅制造。由第二周期元素组成的与BCl3互为等电子体的阴离子为________,该阴离子的中心原子杂化方式为_________。
(3)氨硼烷(H3N→BH3)和Ti(BH4)3均为广受关注的新型储氢材料。
①B与N的电负性:B______N(填“>”“<”或“=”,下同)。
②Ti(BH4)3由TiCl3和LiBH4反应制得。写出制备反应的化学方程式:_________。
(4)磷化硼(BP)是受到高度关注的耐磨材料,它可用作金属表面的保护层。如图为磷化硼晶胞。
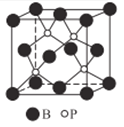
①磷化硼晶体属于______晶体(填晶体类型),是否含有配位键? _____ (填“是”或“否”)
②晶体中P原子的配位数为_____。
③已知BP的晶胞边长为anm,NA为阿伏加德罗常数的数值,则磷化硼晶体的密度为_____g·cm-3(用含a、NA的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.用苯萃取碘水中的碘,后分液,水层从上口倒出
B.金属氧化物都是碱性氧化物
C.三氯化铁溶液滴入氢氧化钠溶液可制备氢氧化铁胶体
D.可用量筒准确量取9.5mL水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由烃A制备抗结肠炎药物H的一种合成路线如下(部分反应略去试剂和条件):

已知:I. ![]()
II. ![]()
回答下列问题:
(1)反应②的类型是_______。
(2)D的结构简式是_______。
(3)G中含有的官能团的名称是_______。
(4)E与足量NaOH溶液反应的化学方程式是_______。
(5)设计C→D和E→F两步反应的共同目的是_______。
(6)化合物X是H的同分异构体,X遇FeCl3溶液不发生显色反应,其核磁共振氢谱显示有3种不同化学环境的氢。峰面积比为3:2:2,写出1种符合要求的X的结构简式_______。
(7)已知![]() 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位。据此写出以A为原料制备化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位。据此写出以A为原料制备化合物![]() 的合成路线_____________________(其他试剂任选)。
的合成路线_____________________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有2molSO2的恒容容器中通入过量氧气发生反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,下列说法中正确的是
2SO3(g) ΔH<0,下列说法中正确的是
A. 氧气过量,所以充分反应后可生成2molSO3
B. 反应达平衡的过程中,混合气体的平均相对分子质量不断减小
C. 反应达平衡后,升高温度,SO2的转化率减小
D. 反应达平衡后,增大SO2的浓度,平衡右移,故SO2的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下CH3COOH和NH3·H2O的电离常数相等,现向10mL浓度为0.01mol/L的氨水溶液中滴加相同浓度的CH3COOH溶液,在滴加过程中溶液的pH与所加醋酸的体积关系如图所示。下列说法错误的是

A. n=7
B. 水的电离程度先增大再减小
C. 常温下,0.01mol/L的氨水溶液中NH3·H2O的电离度为3.98%
D. Y点溶液中c(NH3·H2O)+(OH-)=c(CH3COO-)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在NaCl、MgCl2、MgSO4形成的混合溶液中,c(Na+)=0.1mol/L,c(Mg2+)=0.25mol/L,c(Cl﹣)=0.2mol/L,则c(SO42﹣)为( )
A.0.15 mol/L
B.0.10 mol/L
C.0.25 mol/L
D.0.20 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题
(1)写出漂白粉有效成分的化学式_____。水玻璃的主要成分化学式是_____。
(2)写出醋酸在水溶液中的电离方程式_____。
(3)炼铁、制水泥、玻璃,需要共同的原料是________。
(4)写出镁在二氧化碳中燃烧的化学方程式___________________。
(5)写出二氧化硅与焦炭反应的化学方程式___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com