
【题目】有机物X、Y、Z的分子式均为C7H8,结构简式如图。下列说法正确的是
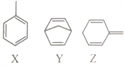
A. X、Y、Z分子中碳原子均能处在同一平面上
B. X、Y、Z三种有机物均能使酸性高锰酸钾溶液褪色
C. 1molX与Z的混合物中含有3mol碳碳双键
D. Y的一氯代物有4种
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】粉末状样品A是由等物质的量的MgO和Al2O3与常见金属氧化物B组成的混合物。A有如图所示的转化关系。
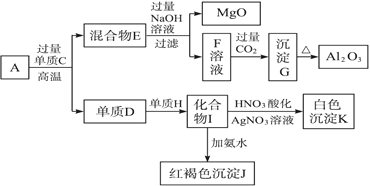
请完成下列问题:
(1) 金属单质C和非金属单质H的化学式分别是__________、_______________
(2) 写出由I生成J的离子方程式:___________________
(3) 写出由F生成G的离子方程式:____________________________
(4) 若10.7 g样品A中MgO、Al2O3和B的物质的量均为0.05 mol,则B的化学式为___________。
(5) 若B中金属原子与氧原子的粒子数之比为2∶3,取7.10 g样品A恰好与含x mol HCl的盐酸完全反应,则x的取值范围是___________(保留小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:
(1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为___________;
(2)CuSO4粉末常用来检验一些有机物中的微量水分,其原因是_______;
(3)SO42-的立体构型是________,其中S原子的杂化轨道类型是_______;
(4)元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子最外层电子排布式为______;一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为_______;该晶体中,原子之间的作用力是________;
(5)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构为CaF2的结构相似,该晶体储氢后的化学式应为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳的氧化物和氮的氧化物与人类生活息息相关,它们之间有多种相互转化关系,可以变废为宝。
(1)为了模拟汽车尾气在催化转化器内的工作反应情况,控制定条件,让反应在恒容密闭容器中进行如下反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g),用传感器测得不同时间NO和CO的依度如下表:
N2(g)+2CO2(g),用传感器测得不同时间NO和CO的依度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)(10-4mol/L) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(NO)(10-3mol/L) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①前2s内的平均反应速率v(N2)=________,此温度下,该反应的平衡常数K=_______
②能说明上述反应达到平衡状态的是____________。
A.2n(CO2)=n(N2) B.混合气体的平均相对分子质量不变
C.气体密度不变 D.容器内气体压强不变
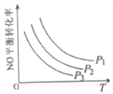
③当NO与CO浓度相等时,体系中NO的平衡转化率与温度、压强的关系如图所示。则NO的平衡转化率随温度升高而减小的原因是___,压强P1、P2、P3的大小关系是____________,理由是_______________________。
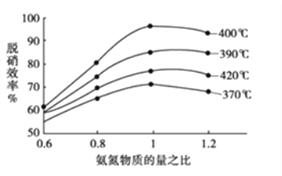
(2)用氨气催化氧化还原法脱硝(NOx)
①根据下图判断提高脱硝效率(单位时间内NOx浓度变化占烟气初始浓度的百分比)的最佳条件是:______________________。
②已知:N2(g)+O2(g)=2NO(g) △H=+akJ/mol
N2(g)+3H2(g)![]() 2NH3(g) △H=-bk/mol
2NH3(g) △H=-bk/mol
2H2(g)+O2(g)=2H2O(g) △H=-ckJ/mol 其中a、b、C均为大于0。
则放热反应:4NO(g)+4NH3(g)+O2(g)![]() 4N2(g)+6H2O(g) △H=____________。
4N2(g)+6H2O(g) △H=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是
A. 15g乙烷分子中含有共价键的数目为3NA
B. 常温常压下,7g乙烯、丙烯的混合物含有原子数为1.5NA
C. 0.1mol/L的AlCl3溶液中含有的铝离子数为0.01NA
D. 25℃时,1L0.1mol/L的CH3COOH溶液中的H+数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有资料显示过量的氨气和氯气在常温下可合成岩脑砂(主要成分为NH4Cl),某实验小组对该反应进行探究,并对岩脑砂进行元素测定。回答下列问题:
I.岩脑砂的制备
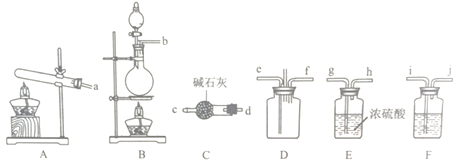
(1)该实验中用浓盐酸与二氧化锰反应制取所需氯气,写出该反应的化学反应方程式_____,装置F中的试剂是___________(填试剂名称)。
(2)为了使氨气和氯气在D中充分混合,请确定上述装置的合理连接顺序:a→____→ef←___(用小写字母和箭头表示,箭头方向与气流方向一致)。
(3)装置D处有两个明显的不足之处,其中之一为:导管太细,生成的氯化按固体会堵塞导管,之二为:___________。
(4)证明氨气和氯气反应有岩脑砂生成,需要的检验试剂(试纸)中,除了蒸馏水、稀HNO3、NaOH溶液外,还需要______。热的浓氯化铵溶液可以清洗溶解铁器表面锈迹,写出相关反应的离子方程式_________________。
II.岩脑砂中元素的测定
准确称取ag岩脑砂,与足量的氧化铜混合加热(2NH4Cl+3CuO![]() 3Cu+N2↑+2HC1↑+3H2O),利用下列装置测定岩脑砂中氮元素和氯元素的质量之比。
3Cu+N2↑+2HC1↑+3H2O),利用下列装置测定岩脑砂中氮元素和氯元素的质量之比。
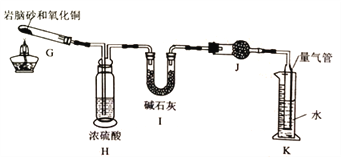
(5)设置装置H的目的是______________。
(6)若装置I增重bg,利用装置K洲得气体体积为VL(已知常温常压下气体摩尔体积为24.5L/mol),则岩脑砂中m(N):m(Cl)=_____(用含b、V的代数式表示,不必化简)。若测量体积时气体温度高于常温(其他操作均正确且忽略气体摩尔体积的改变),则m(N)比正常值______(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列几种有机物:
A.CH4 B.(CH3)2C=CHCH3 C.C2H2 D.C6H14 E.CH2=CHCH=CH2 F.环戊烷
请回答下列问题:[第(1)(3)问请用A、B、C等代码作答,第(4)问请用化学用语作答]
(1)上述有机物中互为同系物的是________,互为同分异构体的是________。
(2)请用系统命名法对B进行命名__________。
(3)发生加聚反应后的产物中具有单双键相间排列结构的单体是__________。
(4)CH4的质谱图上质荷比为16的微粒符号是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com