
【题目】现有下列几种有机物:
A.CH4 B.(CH3)2C=CHCH3 C.C2H2 D.C6H14 E.CH2=CHCH=CH2 F.环戊烷
请回答下列问题:[第(1)(3)问请用A、B、C等代码作答,第(4)问请用化学用语作答]
(1)上述有机物中互为同系物的是________,互为同分异构体的是________。
(2)请用系统命名法对B进行命名__________。
(3)发生加聚反应后的产物中具有单双键相间排列结构的单体是__________。
(4)CH4的质谱图上质荷比为16的微粒符号是________。
科目:高中化学 来源: 题型:
【题目】有机物X、Y、Z的分子式均为C7H8,结构简式如图。下列说法正确的是
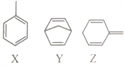
A. X、Y、Z分子中碳原子均能处在同一平面上
B. X、Y、Z三种有机物均能使酸性高锰酸钾溶液褪色
C. 1molX与Z的混合物中含有3mol碳碳双键
D. Y的一氯代物有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只含有Ba2+ Mg2+ Ag+三种阳离子,现用适量的NaOH溶液、稀盐酸和Na2SO4溶液将这三种离子逐一沉淀分离,其流程如图所示:
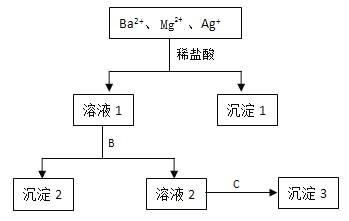
(1)沉淀1的化学式为 ,生成该沉淀的离子方程式为 。
(2)若试剂B为Na2SO4溶液,则沉淀2化学式为 。
(3)若试剂B为NaOH溶液,则生成沉淀2的离子方程式为 。
(4)如果原溶液中Ba2+ Mg2+ Ag+的浓度均为0.1 mol·L-1,且溶液中含有的阴离子只有NO3-,则溶液中NO3- 浓度为 mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为了探究NaClO溶液的性质,设计了下列实验,并记录实验现象。
实验装置 | 实验序号 | 滴管试剂 | 试管试剂 | 实验现象 |
| ① | 0.2 mol/L NaClO溶液 | 饱和Ag2SO4溶液 | 产生白色沉淀 |
② | CH3COOH溶液 | 光照管壁有无色气泡 | ||
③ | 0.2mol/LFeSO4酸性溶液和KSCN溶液 | 溶液变红 | ||
④ | 0.2mol/L的AlCl3溶液 | 产生白色沉淀 |
则以下判断不正确的是
A. 实验①:发生的反应为Ag++ClO-+H2O=AgCl↓+2OH- B. 实验②:无色气体为O2
C. 实验③:还原性强弱顺序Fe2+>Cl- D. 实验④:ClO-与Al3+的水解相互促进
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl)是有机合成中的重要试剂。回答下列问题:
(1)NOCl虽然不稳定,但其原子均达到8e-稳定结构,NOCl的电子式为_________________。
(2)一定条件下,在密闭容器中发生反应:2NOCl(g)![]() 2NO(g)+Cl2(g),其正反应速率表达式为v正=k·cn( NOCl)(k为速率常数),测得v正和c(NOCl)的关系如表:
2NO(g)+Cl2(g),其正反应速率表达式为v正=k·cn( NOCl)(k为速率常数),测得v正和c(NOCl)的关系如表:
序号 | c(NOCl)/(mol·L-1) | v正/(mol·L-1·s-1) |
① | 0.30 | 3.60×10-9 |
② | 0.60 | 1.44×10-8 |
则n=_________;k=___________。
(3)25 ℃时,制备亚硝酰氯所涉及的热化学方程式和平衡常数如表:
序号 | 热化学方程式 | 平衡常数 |
① | 2NO2(g)+NaCl(s) | K1 |
② | 4NO2(g)+2NaCl(s) | K2 |
③ | 2NO(g)+Cl2(g) | K3 |
则该温度下,ΔH3=______kJ/mol;K3=______(用K1和K2表示)。
(4)25℃时,在体积为2L的恒容密闭容器中通入0.08 mol NO和0.04 molCl2发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图曲线a所示,则ΔH3=______(填“>”“<”或“=”)0;若其他条件相同,仅改变某一条件,测得其压强(p)随时间(t)
的变化如图曲线b所示,则改变的条件是_____________;K3=___________L/mol;在5 min时,再充入0.08 mol NO和0.04 molCl2,则混合气体的平均相对分子质量将_____________(填“增大”、“减小”或“不变”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在碱性溶液中可发生如下反应:2R(OH)3+3ClO﹣+4OH﹣═2RO4n﹣+3Cl﹣+5H2O,则RO4n﹣中R的化合价是( )
A.+3
B.+4
C.+5
D.+6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组用如图装置制取溴苯,并证明反应为取代反应。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
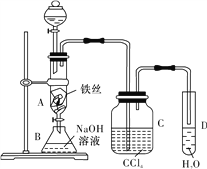
(1)观察到A中的现象是________________,D中导管口可观察到的现象是________________。
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是__________________________。
(3)C中盛放CCl4的作用是________________。
(4)若要证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入________溶液,若观察到________________,即能证明。
(5)将锥形瓶中液体分液,得到的溴苯中仍含有杂质________及少量水分,用固体无水硫酸钠等作吸水剂可除去水分,另一种杂质的除去方法是________________(已知溴苯不溶于水,密度大于水,沸点156 ℃)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各溶液中一定能大量共存的离子组是( )
A. 使酚酞溶液呈红色的溶液中:Mg2+、Cu2+、SO![]() 、K+
、K+
B. 使pH试纸呈红色的溶液中:Fe2+、K+、NO![]() 、Cl-
、Cl-
C. c(H+)=10-14 mol·L-1溶液中:Na+、AlO![]() 、S2-、SO
、S2-、SO![]()
D. 水电离出的c(H+)为10-12mol·L-1的溶液中:K+、Na+、CO![]() 、Ca2+
、Ca2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】传统的定量化学实验受到计量手段的制约而研究范围狭窄、精确度不高。DIS数字化信息系统(由传感器、数据采集器和计算机组成)因为可以准确测量溶液的pH等,所以在中和滴定的研究中应用越来越广泛。
(1)某学习小组利用DIS系统测定某醋酸溶液的物质的量浓度,以测量溶液导电能力来判断滴定终点,实验步骤如下:
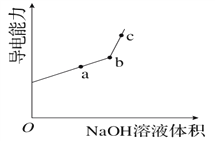
①用__________(填仪器名称)量取20.00 mL醋酸溶液样品,倒入洁净干燥锥形瓶中,连接好DIS系统。如果锥形瓶中含有少量蒸馏水,测量结果将______________(选填“偏大”、“偏小”或“不影响”)。向锥形瓶中滴加0.1000 mol·L-1的NaOH溶液,计算机屏幕上显示出溶液导电能力与加入NaOH溶液体积关系的曲线图如下图。

②醋酸与NaOH溶液反应的离子方程式为___________________________。
③图中b点时,溶液中各离子浓度大小的关系是_________________。
④若图中某一点pH等于8,则c(Na+)—c(CH3COO-)的精确值为________。
(2)将体积为10 mL pH=2的醋酸溶液与HX溶液分别加水稀释至1 000 mL,稀释过程pH的变化曲线如图所示,则HX的电离平衡常数________(填“大于”“等于”或“小于”,下同)醋酸的电离平衡常数;稀释后,HX溶液中由水电离出来的c(H+)______醋酸溶液中由水电离出来的 c(H+)。
(3)25 ℃时,CH3COOH的电离平衡常数K=1.8×10-5。在0.5 mol·L-1的CH3COOH溶液中由CH3COOH电离出的c(H+)约是由水电离出的c(H+)的______倍。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com