
【题目】已知在碱性溶液中可发生如下反应:2R(OH)3+3ClO﹣+4OH﹣═2RO4n﹣+3Cl﹣+5H2O,则RO4n﹣中R的化合价是( )
A.+3
B.+4
C.+5
D.+6
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】已知某化学反应的平衡常数表达式为K=![]() ,在不同的温度下该反应的平衡常数如表所示:
,在不同的温度下该反应的平衡常数如表所示:
t ℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
下列有关叙述不正确的是( )
A. 该反应的化学方程式是:CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
B. 上述反应的正反应是放热反应
C. 如果在一定体积的密闭容器中加入CO2和H2各1 mol,5 min后温度升高到830 ℃,此时测得CO2为0.4 mol时,该反应达到平衡状态
D. 某温度下,如果平衡浓度符合下列关系式:![]() =
=![]() ,判断此时的温度是1000 ℃
,判断此时的温度是1000 ℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z在周期表中的位置如下图所示,则下列说法中错误的是
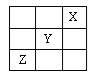
A. X元素的最外层电子数为2
B. Y的气态氢化物的化学式为HY
C. Z的最高价氧化物的化学式为ZO2
D. X、Y、Z的单质中X单质最稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列几种有机物:
A.CH4 B.(CH3)2C=CHCH3 C.C2H2 D.C6H14 E.CH2=CHCH=CH2 F.环戊烷
请回答下列问题:[第(1)(3)问请用A、B、C等代码作答,第(4)问请用化学用语作答]
(1)上述有机物中互为同系物的是________,互为同分异构体的是________。
(2)请用系统命名法对B进行命名__________。
(3)发生加聚反应后的产物中具有单双键相间排列结构的单体是__________。
(4)CH4的质谱图上质荷比为16的微粒符号是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国“9.11”恐怖袭击事件中,毁坏的建筑物发出大量石棉,人吸入石棉纤维易患肺癌。石棉是硅酸盐矿物,某种石棉的化学式为:CaMgxAlySi3O12,该化学式中x、y的值分别是( )
A.2、2B.2、3C.3、2D.4、3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/L HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2逸出未画出)的物质的量分数随溶液pH变化的部分情况如图所示,下列说法错误的是
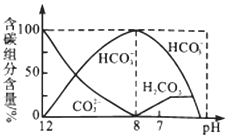
A.在同一溶液中,H2CO3、HCO3-、CO32-不能大量共存
B.已知在25℃,CO32-的水解平衡常数Kh1=2×10-4,当溶液的pH=10时,溶液中c(HCO3-):c(CO32-)=2: 1
C.pH=7时溶液中各种离子其物质的量浓度的大小关系是c(Na+)>c(HCO3-)>c(Cl-)>c(H+)=c(OH-)>c(CO32-)
D.当混合液pH≈6时,开始放出CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于反应2KI+O3+H2O ==2KOH+I2+O2,下列说法正确的是
A.当有2 molKI被氧化时,2 mol氧原子被还原
B.O2是还原产物
C.若消耗2.24 L O3,则转移0.2 mol电子
D.氧化剂与还原产物的物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤炭燃烧产生的SO2、CO、NO2等造成了严重的大气污染问题。
(1) CaO能起到固硫、降低SO2排放量的作用。
已知:①SO2(g)+ CaO(s)=CaSO3(s) △H=-402 kJ·mol-1
②2CaSO3(s)+O2(g)=2CaSO4(s) △H=-234 kJ·mol-1
③CaCO3(s)=CO2(g) +CaO(s) △H = +178 kJ·mol-1
则反应2SO2(g)+O2(g)+2CaO(s)= 2CaSO4(s) △H =________ kJ·mol-1
向燃煤中加入CaCO3也可起到固硫作用,若固定2molSO2相应量的煤在相同条件下,燃烧时向环境释放出的热量会减少______ kJ。
(2)利用CO和H2在催化剂作用下合成甲醇,是减少污染的一种新举措,反应原理为CO(g)+2H2(g) ![]() CH3OH(g)△H,在体积不同的两个恒容密闭容器中分别充入1molCO和2mol H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图甲。
CH3OH(g)△H,在体积不同的两个恒容密闭容器中分别充入1molCO和2mol H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图甲。
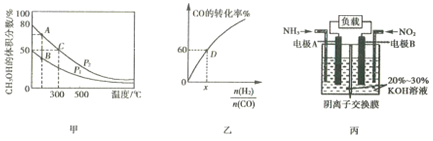
①上述合成甲醇的反应是______(填“吸热”或“放热”)反应,判断的理由是_____。
②图甲中A、B、C三点中反应速率最大的是______(填写“A”、“ B” 或“ C”)。
③在300℃时,向C点平衡体系中再充入0.25molCO,0.5molH2和0.25molCH3OH,该平衡______(填“向正反应方向”、“向逆反应方向”或“不”)移动。
(3)一定温度下,CO的转化率与起始投料比![]() 的变化关系如图乙所示,测得D点氢气的转化率为40%,则x=______。
的变化关系如图乙所示,测得D点氢气的转化率为40%,则x=______。
(4)利用原电池原理可将NO2和NH3转化为无污染物质,其装置原理图如图丙所示,则负极反应式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com