
【题目】煤炭燃烧产生的SO2、CO、NO2等造成了严重的大气污染问题。
(1) CaO能起到固硫、降低SO2排放量的作用。
已知:①SO2(g)+ CaO(s)=CaSO3(s) △H=-402 kJ·mol-1
②2CaSO3(s)+O2(g)=2CaSO4(s) △H=-234 kJ·mol-1
③CaCO3(s)=CO2(g) +CaO(s) △H = +178 kJ·mol-1
则反应2SO2(g)+O2(g)+2CaO(s)= 2CaSO4(s) △H =________ kJ·mol-1
向燃煤中加入CaCO3也可起到固硫作用,若固定2molSO2相应量的煤在相同条件下,燃烧时向环境释放出的热量会减少______ kJ。
(2)利用CO和H2在催化剂作用下合成甲醇,是减少污染的一种新举措,反应原理为CO(g)+2H2(g) ![]() CH3OH(g)△H,在体积不同的两个恒容密闭容器中分别充入1molCO和2mol H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图甲。
CH3OH(g)△H,在体积不同的两个恒容密闭容器中分别充入1molCO和2mol H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图甲。
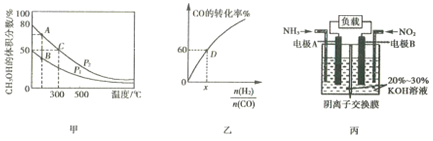
①上述合成甲醇的反应是______(填“吸热”或“放热”)反应,判断的理由是_____。
②图甲中A、B、C三点中反应速率最大的是______(填写“A”、“ B” 或“ C”)。
③在300℃时,向C点平衡体系中再充入0.25molCO,0.5molH2和0.25molCH3OH,该平衡______(填“向正反应方向”、“向逆反应方向”或“不”)移动。
(3)一定温度下,CO的转化率与起始投料比![]() 的变化关系如图乙所示,测得D点氢气的转化率为40%,则x=______。
的变化关系如图乙所示,测得D点氢气的转化率为40%,则x=______。
(4)利用原电池原理可将NO2和NH3转化为无污染物质,其装置原理图如图丙所示,则负极反应式为______________。
【答案】 -1038 356 放热 升高温度,CH3OH的体积分数减小,平衡逆向移动,正反应放热 C 向正反应方向 3 2NH3-6e-+6OH-=N2+6H2O
【解析】分析:(1) 根据盖斯定律将①SO2(g)+ CaO(s)=CaSO3(s) △H=-402 kJ·mol-1,②2CaSO2(s)+O2(g)=2CaSO3(s)△H=-234 kJ·mol-1按照①×2+②处理即可;燃烧时向环境释放出的热量会减少的热量为碳酸钙分解吸收的热量;
(2)①根据图像甲,升高温度,CH3OH的体积分数逐渐减小,说明平衡逆向移动;②首先根据图像甲分析判断出P2>P1,温度越高,压强越大,反应速率越快;③首先计算判断平衡时C点的组成,在分析恒容容器中再充入0.25molCO,0.5molH2和0.25molCH3OH,对平衡的影响;
(3) 根据图像乙,D点CO的转化率为60%,结合D点氢气的转化率计算判断x的值;
(4) NO2和NH3转化为无污染物质为氮气和水,负极上氨气发生氧化反应。
详解:(1) ①SO2(g)+ CaO(s)=CaSO3(s) △H=-402 kJ·mol-1,②2CaSO2(s)+O2(g)=2CaSO3(s) △H=-234 kJ·mol-1,③CaCO3(s)=CO2(g) +CaO(s) △H = +178 kJ·mol-1,根据盖斯定律,将①×2+②得:2SO2(g)+O2(g)+2CaO(s)= 2CaSO4(s) △H =(-402 kJ·mol-1)×2+(-234 kJ·mol-1)= -1038kJ·mol-1;向燃煤中加入CaCO3也可起到固硫作用,若固定2molSO2相应量的煤,根据方程式,固定2molSO2,放出1038kJ的热量,同时需要分解2mol CaCO3,需要吸热356 kJ,因此在相同条件下,燃烧时向环境释放出的热量会减少356 kJ,故答案为:-1038;356;
(2)①根据图像,升高温度,CH3OH的体积分数逐渐减小,说明平衡逆向移动,合成甲醇的反应是放热反应,故答案为:放热;升高温度,CH3OH的体积分数减小,平衡逆向移动,正反应放热;
②CO(g)+2H2(g) ![]() CH3OH(g)是气体的物质的量减小的反应,压强越大,平衡时CH3OH的体积分数越大,则P2>P1,温度越高,压强越大,反应速率越快,图甲中A、B、C三点中反应速率最大的是C,故答案为:C;
CH3OH(g)是气体的物质的量减小的反应,压强越大,平衡时CH3OH的体积分数越大,则P2>P1,温度越高,压强越大,反应速率越快,图甲中A、B、C三点中反应速率最大的是C,故答案为:C;
③C点 CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)
起始(mol) 1 2 0
反应(mol) x 2x x
平衡(mol)1-x 2-2x x
则![]() ×100%=50%,解得:x=0.75mol,因此平衡时有0.25molCO,0.5molH2和0.75molCH3OH,恒容容器中再充入0.25molCO,0.5molH2和0.25molCH3OH,可以看成先充入
×100%=50%,解得:x=0.75mol,因此平衡时有0.25molCO,0.5molH2和0.75molCH3OH,恒容容器中再充入0.25molCO,0.5molH2和0.25molCH3OH,可以看成先充入![]() molCO,
molCO,![]() molH2和0.25molCH3OH,相当于增大压强,再充入
molH2和0.25molCH3OH,相当于增大压强,再充入![]() molCO,
molCO,![]() molH2,平衡均正向移动,故答案为:向正反应方向;
molH2,平衡均正向移动,故答案为:向正反应方向;
(3) D点CO的转化率为60%,
CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)
起始(mol) 1 x 0
反应(mol) 0.6 1.2 0.6
平衡(mol)0.4 x-1.2 0.6
D点氢气的转化率为40%=![]() ,x=3,故答案为:3;
,x=3,故答案为:3;
(4)利用原电池原理可将NO2和NH3转化为无污染物质氮气和水,负极上氨气发生氧化反应,反应式为2NH3-6e-+6OH-=N2+6H2Ospan>,故答案为:2NH3-6e-+6OH-=N2+6H2O。


科目:高中化学 来源: 题型:
【题目】已知在碱性溶液中可发生如下反应:2R(OH)3+3ClO﹣+4OH﹣═2RO4n﹣+3Cl﹣+5H2O,则RO4n﹣中R的化合价是( )
A.+3
B.+4
C.+5
D.+6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示渗透作用装置图,其中半透膜为膀胱膜,甲、丙装置中A、B、a、b溶液浓度分别用MA、MB、Ma、Mb表示,乙、丁装置分别表示一段时间后甲、丙装置的状态,液面上升的高度分别为h1、h2。如果A、B、a、b均为蔗糖溶液,且MA>MB,Ma=Mb>MA,则达到平衡后( )
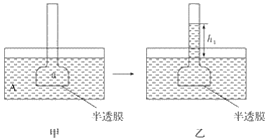
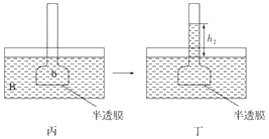
A. h1>h2、Ma>MbB. h1>h2、Ma<Mb
C. h1<h2、Ma<MbD. h1<h2、Ma>Mb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)是一种新型绿色水处理剂。 工业上可用电解浓NaOH溶液制备Na2FeO4,其工作原理如图所示,两端隔室中离子不能进入中间隔室。下列说法错误的是

A. 阳极电极反应式:Fe-6e- +8OH-=FeO42- +4H2O
B. 甲溶液可循环利用
C. 离子交换膜a是阴离子交换膜
D. 当电路中通过2mol电子的电量时,会有1molH2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】传统的定量化学实验受到计量手段的制约而研究范围狭窄、精确度不高。DIS数字化信息系统(由传感器、数据采集器和计算机组成)因为可以准确测量溶液的pH等,所以在中和滴定的研究中应用越来越广泛。
(1)某学习小组利用DIS系统测定某醋酸溶液的物质的量浓度,以测量溶液导电能力来判断滴定终点,实验步骤如下:
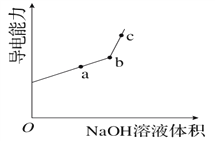
①用__________(填仪器名称)量取20.00 mL醋酸溶液样品,倒入洁净干燥锥形瓶中,连接好DIS系统。如果锥形瓶中含有少量蒸馏水,测量结果将______________(选填“偏大”、“偏小”或“不影响”)。向锥形瓶中滴加0.1000 mol·L-1的NaOH溶液,计算机屏幕上显示出溶液导电能力与加入NaOH溶液体积关系的曲线图如下图。

②醋酸与NaOH溶液反应的离子方程式为___________________________。
③图中b点时,溶液中各离子浓度大小的关系是_________________。
④若图中某一点pH等于8,则c(Na+)—c(CH3COO-)的精确值为________。
(2)将体积为10 mL pH=2的醋酸溶液与HX溶液分别加水稀释至1 000 mL,稀释过程pH的变化曲线如图所示,则HX的电离平衡常数________(填“大于”“等于”或“小于”,下同)醋酸的电离平衡常数;稀释后,HX溶液中由水电离出来的c(H+)______醋酸溶液中由水电离出来的 c(H+)。
(3)25 ℃时,CH3COOH的电离平衡常数K=1.8×10-5。在0.5 mol·L-1的CH3COOH溶液中由CH3COOH电离出的c(H+)约是由水电离出的c(H+)的______倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某致病细菌分泌的外毒素,无色,细针状结晶,对小鼠和人体有很强的毒性,可引起流涎、呕吐、便血、痉挛等,以致死亡。该外毒素为环状肽,结构式如图所示,请据图分析回答:

(1)该化合物中含有游离的氨基_____________个,羧基________________个。
(2)该化合物是由_____________个氨基酸组成的,区别这些氨基酸的种类是依靠其结构中的_____________。
(3)组成该化合物的氨基酸有___________种,其中有_____________个氨基酸的R基相同,这个R基是_______________。
(4)该化合物称为环状__________肽化合物,含有___________个肽键。
(5)填写虚线框内结构的名称:A._________________,B.___________________。
(6)该化合物具有8个氮原子,其中_____________个位于肽键上,____________个位于R基上。
(7)该外毒素环肽在形成过程中失去了______________个水分子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛(Ti)被称为继铁、铝之后的第三金属,用TiO2制取Ti的主要反应有①TiO2+2C+2Cl2![]() TiCl4+2CO、②TiCl4+2Mg
TiCl4+2CO、②TiCl4+2Mg![]() 2MgCl2+Ti。下列叙述正确的是
2MgCl2+Ti。下列叙述正确的是
A. 反应①是置换反应 B. 反应②是复分解反应
C. 反应①中TiO2是氧化剂 D. 反应②中金属镁具有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大。
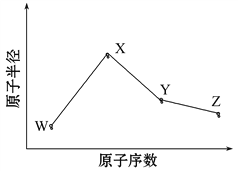
(1)X位于元素周期表中第________周期第________族;W的基态原子核外有________个未成对电子。
(2)Z的气态氢化物和溴化氢相比,较稳定的是________(写化学式)。
(3)Y与Z形成的化合物和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式是____________________________________________________。
(4)在25 ℃、101 kPa下,已知Y的气态氢化物在氧气中完全燃烧后恢复至原状态,平均每转移1 mol电子放热190.0 kJ,该反应的热化学方程式是_________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com