
【题目】常温下将NaOH溶液滴加到亚硒酸(H2SeO3)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是
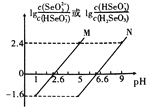
A. Ka1(H2SeO3)的数量级为10-7
B. 曲线M表示pH与lg![]() 的变化关系
的变化关系
C. NaHSeO3溶液中c(OH-)>c(H+)
D. 混合溶液中:lg![]() - lg
- lg![]() =lgKa1(H2SeO3)-lgKa2(H2SeO3)=4
=lgKa1(H2SeO3)-lgKa2(H2SeO3)=4
【答案】D
【解析】分析:当lg![]() 与lg
与lg![]() 相等时,曲线M的pH小于N曲线,H2SeO3分步电离且一级电离常数远大于二级电离常数,曲线M表示pH与lg
相等时,曲线M的pH小于N曲线,H2SeO3分步电离且一级电离常数远大于二级电离常数,曲线M表示pH与lg![]() 的变化关系,曲线N表示pH与lg
的变化关系,曲线N表示pH与lg![]() 的变化关系。根据曲线M上的点(2.6,0)计算Ka1(H2SeO3),进一步计算HSeO3-的水解平衡常数;根据曲线N上的点(6.6,0)计算Ka2(H2SeO3),由HSeO3-的电离平衡常数和水解平衡常数的大小判断NaHSeO3溶液的酸碱性;由电离平衡常数表达式和关键点计算lg
的变化关系。根据曲线M上的点(2.6,0)计算Ka1(H2SeO3),进一步计算HSeO3-的水解平衡常数;根据曲线N上的点(6.6,0)计算Ka2(H2SeO3),由HSeO3-的电离平衡常数和水解平衡常数的大小判断NaHSeO3溶液的酸碱性;由电离平衡常数表达式和关键点计算lg![]() - lg
- lg![]() 。
。
详解:当lg![]() 与lg
与lg![]() 相等时,曲线M的pH小于N曲线,H2SeO3分步电离且一级电离常数远大于二级电离常数,曲线M表示pH与lg
相等时,曲线M的pH小于N曲线,H2SeO3分步电离且一级电离常数远大于二级电离常数,曲线M表示pH与lg![]() 的变化关系,曲线N表示pH与lg
的变化关系,曲线N表示pH与lg![]() 的变化关系。A项,H2SeO3的电离方程式为:H2SeO3
的变化关系。A项,H2SeO3的电离方程式为:H2SeO3![]() H++HSeO3-、HSeO3-
H++HSeO3-、HSeO3-![]() H++SeO32-,H2SeO3的电离平衡常数Ka1(H2SeO3)=
H++SeO32-,H2SeO3的电离平衡常数Ka1(H2SeO3)=![]() ,曲线M上当lg
,曲线M上当lg![]() =0时溶液的pH=2.6,即
=0时溶液的pH=2.6,即![]() =1时溶液中c(H+)=10-2.6mol/L,Ka1(H2SeO3)=10-2.6=100.4
=1时溶液中c(H+)=10-2.6mol/L,Ka1(H2SeO3)=10-2.6=100.4![]() 10-3,Ka1(H2SeO3)的数量级为10-3,H2SeO3的电离平衡常数Ka2(H2SeO3)=
10-3,Ka1(H2SeO3)的数量级为10-3,H2SeO3的电离平衡常数Ka2(H2SeO3)=![]() ,曲线N上当lg
,曲线N上当lg![]() =0时溶液的pH=6.6,即
=0时溶液的pH=6.6,即![]() =1时溶液中c(H+)=10-6.6mol/L,Ka2(H2SeO3)=10-6.6=100.4
=1时溶液中c(H+)=10-6.6mol/L,Ka2(H2SeO3)=10-6.6=100.4![]() 10-7,Ka2(H2SeO3)的数量级为10-7,A项错误;B项,lg
10-7,Ka2(H2SeO3)的数量级为10-7,A项错误;B项,lg![]() 与lg
与lg![]() 相等时,曲线M的pH小于N曲线,H2SeO3分步电离且一级电离常数远大于二级电离常数,曲线M表示pH与lg
相等时,曲线M的pH小于N曲线,H2SeO3分步电离且一级电离常数远大于二级电离常数,曲线M表示pH与lg![]() 的变化关系,B项错误;C项,NaHSeO3溶液中既存在HSeO3-的电离平衡,又存在HSeO3-的水解平衡,HSeO3-水解平衡方程式为HSeO3-+H2O
的变化关系,B项错误;C项,NaHSeO3溶液中既存在HSeO3-的电离平衡,又存在HSeO3-的水解平衡,HSeO3-水解平衡方程式为HSeO3-+H2O![]() H2SeO3+OH-,HSeO3-的水解平衡常数Kh=
H2SeO3+OH-,HSeO3-的水解平衡常数Kh=![]() =
=![]() =
=![]() =
=![]() =10-11.4
=10-11.4![]() Ka2(H2SeO3)=10-6.6,HSeO3-的电离程度大于HSeO3-的水解程度,溶液呈酸性,NaHSeO3溶液中c(H+)
Ka2(H2SeO3)=10-6.6,HSeO3-的电离程度大于HSeO3-的水解程度,溶液呈酸性,NaHSeO3溶液中c(H+)![]() c(OH-),C项错误;D项,lg
c(OH-),C项错误;D项,lg![]() - lg
- lg![]() =lg
=lg![]() -lg
-lg![]() =lgKa1(H2SeO3)-lg Ka2(H2SeO3)=lg10-2.6-lg10-6.6=-2.6-(-6.6)=4,D项正确;答案选D。
=lgKa1(H2SeO3)-lg Ka2(H2SeO3)=lg10-2.6-lg10-6.6=-2.6-(-6.6)=4,D项正确;答案选D。


科目:高中化学 来源: 题型:
【题目】《中国诗词大会》不仅弘扬了中华传统文化,还蕴含着许多化学知识。下列诗句的有关说法错误的是
A. 王安石诗句“雷蟠电掣云滔滔,夜半载雨输亭皋”。雷雨天实现了大气中氮的固定
B. 于谦诗句“凿开混沌得乌金,藏蓄阳和意最深”。“ 乌金”指的是石油
C. 赵孟頫诗句“纷纷灿烂如星陨,霍霍喧逐似火攻”。灿烂的烟花与某些金属元素的焰色反应有关
D. 刘禹锡诗句“千淘万漉虽辛苦,吹尽黄沙始到金”。金性质稳定,存在游离态,可用物理方法获得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生活和社会可持续发展关系密切。下列措施正确的是
①将酒精和84消毒液混用,提高杀灭新冠病毒的效果;②研发易降解的生物农药;③应用高效洁净的能源转换技术;④田间焚烧秸秆;⑤推广使用节能环保材料
A.①③⑤B.②③⑤C.①②④D.②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国炼丹家约在唐代或五代时期掌握了以炉甘石点化鍮石(即鍮石金)的技艺:将炉甘石(ZnCO3)、赤铜矿(主要成分Cu2O)和木炭粉混合加热至800℃左右可制得与黄金相似的鍮石金。回答下列问题:
(1)锌元素基态原子的价电子排布式为________________,铜元素基态原子中的未成对电子数为_________________。
(2)硫酸锌溶于过量氨水形成[Zn(NH3)4]SO4溶液。
①[Zn(NH3)4]SO4中,阴离子的立体构型是__________________,[Zn(NH3)4]2+中含有的化学键有__________________。
②NH3分子中,中心原子的轨道杂化类型为________________,NH3在H2O中的溶解度____________(填“大”或“小”),原因是_____________________。
(3)铜的第一电离能为I1Cu=745.5kJ·mol-1,第二电离能为I2Cu=1957.9kJ·mol-1,锌的第一电离能为I1Zn=906.4kJ·mol-1,第二电离能为I2Zn=1733.3kJ·mol-1,I2Cu>I2Zn的原因是___________________。
(4)Cu2O晶体的晶胞结构如图所示。O2-的配位数为_______________;若Cu2O的密度为dg·cm-3,则晶胞参数a=____________nm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置,其中试剂b为浓硫酸,则下列实验设计能达到实验目的的是
选项 | 试剂a | 试剂c | 实验目的 |
|
A | MnO2和NaCl | 紫色石蕊溶液 | 验证Cl2的漂白性 | |
B | 蔗糖 | 澄清石灰水 | 验证CO2的生成 | |
C | FeS | 溴水 | 验证非金属性:Br>S | |
D | Na2SO3 | 品红溶液 | 验证SO2的漂白性 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com