
 CH4 (g)+2H2O(g)
CH4 (g)+2H2O(g)


科目:高中化学 来源:不详 题型:单选题
| A.vA=0.15mol/(L?min) | B.vB=0.6mol/(L?s) |
| C.vC=0.2mol/(L?min) | D.vD=0.01mol/(L?s) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 R(g)+S(g)在恒温下已达到平衡的是( )
R(g)+S(g)在恒温下已达到平衡的是( )| A.反应容器内的压强不随时间改变 | B.反应容器内P、Q、R、S四者共存 |
| C.P的生成速率和S的生成速率相等 | D.反应容器内的气体总物质的量不随时间变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.CO2(g)+2NH3( g) CO(NH2)2(s)+H2O(g); △H<0 CO(NH2)2(s)+H2O(g); △H<0 |
B.CO2(g)+ H2(g)  CO(g)+H2O(g); △H>0 CO(g)+H2O(g); △H>0 |
C.CH3CH2OH CH2=CH2(g)+ H2O(g); △H>0 CH2=CH2(g)+ H2O(g); △H>0 |
D.2C6H5CH2CH3(g)+O2(g) 2C6H-5CH=CH2(g)+2H2O(g); △H<0 2C6H-5CH=CH2(g)+2H2O(g); △H<0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
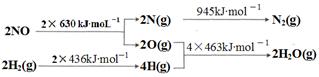
 2NO+O2在体积不变的密闭容器中反应,达到平衡状态的标志是
2NO+O2在体积不变的密闭容器中反应,达到平衡状态的标志是| A.①③⑤ | B.②③⑤ | C.①③④ | D.①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
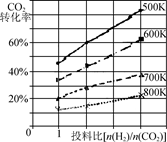
 CH3OCH3(g)+3H2O(g);ΔH
CH3OCH3(g)+3H2O(g);ΔH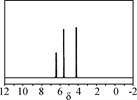
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 B(g)+C(g) △H=+85.1kJ·mol-1(吸热反应)
B(g)+C(g) △H=+85.1kJ·mol-1(吸热反应)| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
| 反应时间t/h | 0 | 4 | 8 | 16 |
| C(A)/(mol·L-1) | 0.10 | a | 0.026 | 0.0065 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
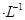 盐酸与0.2 mol
盐酸与0.2 mol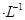 氨水等体积混合,所得混合溶液pH______7(填“>”“<”或“=”,下同),混合溶液中
氨水等体积混合,所得混合溶液pH______7(填“>”“<”或“=”,下同),混合溶液中 (25℃时,NH3.H2O的电离常数
(25℃时,NH3.H2O的电离常数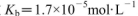 )
)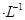 的MgCl2溶液中逐滴加入适量0.lmol
的MgCl2溶液中逐滴加入适量0.lmol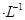 氨水,有白色沉淀生成,向反应后的浊液中,继续加入O.lmol
氨水,有白色沉淀生成,向反应后的浊液中,继续加入O.lmol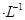 的FeCl3溶液,观察到的现象是______ ;上述过程中发生的所有反应的离子方程式为______。(25℃时,
的FeCl3溶液,观察到的现象是______ ;上述过程中发生的所有反应的离子方程式为______。(25℃时,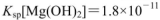 ,
,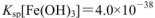 )
)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
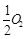 (g)=CO(g)ΔH1=-126.4kJ/mol ①
(g)=CO(g)ΔH1=-126.4kJ/mol ① CH3OH(g)。
CH3OH(g)。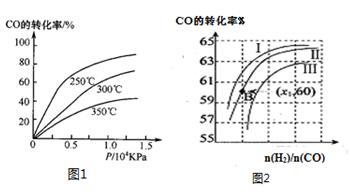
| A.正反应速率先增大后减小 | B.逆反应速率先增大后减小 |
| C.化学平衡常数K值增大 | D.反应物的体积百分含量增大 |
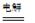 CH3CHOH+CH3CHOOH。
CH3CHOH+CH3CHOOH。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com