
【题目】铁屑和氯气在500~600 ℃ 下可制取无水FeCl3 ,实验装置如下图。下列说法正确的是( )

A. 分液漏斗中盛放的试剂是稀盐酸
B. 实验时应先点燃I 中酒精灯,再点燃Ⅲ中酒精灯
C. 洗气瓶中盛放的试剂是饱和食盐水
D. 烧杯中盛放的试剂是澄清石灰水,目的是吸收尾气
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:
【题目】德国化学家凯库勒认为:苯分子是由6个碳原子以单双键相互交替结合而成的环状结构.为了验证凯库勒有关苯环的观点,甲同学设计了如图实验方案。

①按如图所示的装置图连接好各仪器;
②检验装置的气密性;
③在A中加入适量的苯和液溴的混合液体,再加入少最铁粉,塞上橡皮塞,打开止水夹K1、K2、K3;
④待C中烧瓶收集满气体后,将导管b的下端插入烧杯里的水中,挤压預先装有水的胶头滴管的胶头,观察实验现象。
请回答下列问题。
(1)A中所发生反应的反应方程式为_______,能证明凯库勒观点错误的实验现象是________。
(2)装置B的作用是________。
(3)C中烧瓶的容积为500mL,收集气体时,由于空气未排尽,最终水未充满烧瓶,假设烧瓶中混合气体对H2的相对密度为37.9,则实验结束时,进入烧瓶中的水的体积为_____ mL (空气的平均相对分子质量为29)。
(4)已知乳酸的结构简式为![]() 。试回答:
。试回答:
①乳酸分子中含有______和_______两种官能团(写名称)。
②乳酸跟氢氧化钠溶液反应的化学方程式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验.
实验I:反应产物的定性探究,按如图装置(固定装置已略去)进行实验

(1)A装置的试管中发生反应的化学方程式是_____________________;F装置的烧杯中发生反应的离子方程式是__________________________;B装置中的现象是_________。
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是______________ 。
(3)实验结束时,撤去所有酒精灯之前必须完成的实验操作是_________________。
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子,需将溶液稀释,操作方法是________________________________。
实验Ⅱ:反应产物的定量探究
(5)在铜与浓硫酸反应的过程中,发现有黑色物质出现,且黑色物质为Cu2S。产生Cu2S的反应为aCu+bH2SO4 ![]() cCu2S+dCuSO4+e H2O,则a:b=______________。
cCu2S+dCuSO4+e H2O,则a:b=______________。
(6)为测定硫酸铜的产率,将该反应所得溶液中和后配制成250.00mL溶液,取该溶液25.00mL加入足量KI溶液中振荡,生成的I2恰好与20.00mL 0.30molL﹣1的Na2S2O3溶液反应,若反应消耗铜的质量为6.4g,则硫酸铜的产率为_________________。(已知2Cu2++4I﹣=2CuI+I2, 2S2O32﹣+I2=S4O62﹣+2I﹣) 【注:硫酸铜的产率指的是硫酸铜的实际产量与理论产量的比值】
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知链烃A 的分子式为C6Hx,它与足量的溴水反应生成C6HxBr2,该生成物中含有两个甲基,则满足上述条件(不考虑立体异构)的链烃A的结构有
A. 5种 B. 6种 C. 7种 D. 9种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可充电“钠·二氧化碳”电池(如图),电池总反应为:4Na+3CO2![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是

A. 放电时,Na+向正极移动
B. 放电时,电子从钠薄经负载流向多壁纳米碳管
C. 充电时,钠薄和外接电源的负极相连,发生氧化反应
D. 充电时,阳极的电极反应为:2Na2CO3+C-4e-=4Na++3CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现今太阳能光伏产业蓬勃发展,推动了高纯硅的生产与应用。回答下列问题:
Ⅰ.工业上用“西门子法”以硅石(SiO2)为原料制备冶金级高纯硅的工艺流程如下图所示:

己知:SiHCl3 室温下为易挥发、易水解的无色液体。
(1)“还原”过程需要在高温条件下,该反应的主要还原产物为_____________。
(2)“氧化”过程反应温度为200~300℃,该反应的化学方程式为__________。
(3)“氧化”、“分离”与“热解”的过程均需要在无水、无氧的条件下,原因是_________________。
(4)上述生产工艺中可循环使用的物质是_________、________(填化学式)。
Ⅱ.冶金级高纯硅中常含有微量的杂质元素,比如铁、硼等,需对其进行测定并除杂,以进一步提高硅的纯度。
(5)测定冶金级高纯硅中铁元素含量
将m g 样品用氢氟酸和硝酸溶解处理,配成V mL 溶液,用羟胺(NH2OH,难电离)将Fe3+还原为Fe2+后,加入二氮杂菲,形成红色物质。利用吸光度法测得吸光度A 为0.500(吸光度A与Fe2+浓度对应曲线如图)。

① 酸性条件下,羟胺将Fe3+还原为Fe2+,同时产生一种无污染气体,该反应的离子方程式为__________________________________。
② 样品中铁元素的质量分数表达式为____________________(用字母表示)。
(6)利用氧化挥发法除冶金级高纯硅中的硼元素
采用Ar等离子焰,分别加入O2或CO2,研究硼元素的去除率和硅元素的损失率,实验结果如下图所示。在实际生产过程,应调节O2或CO2的合理比例的原因是________________。
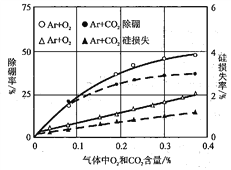
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应N2+3H2![]() 2NH3的能量变化如图所示,该反应的热化学方程式是
2NH3的能量变化如图所示,该反应的热化学方程式是

A. N2(g)+3H2(g) ![]() 2NH3(l) △H=2(a-b--c)kJ/mol
2NH3(l) △H=2(a-b--c)kJ/mol
B. N2(g)+3H2(g) ![]() 2NH3(l) △H=2(b-a)kJ/mol
2NH3(l) △H=2(b-a)kJ/mol
C. 1/2 N2(g)+3/2H2(g) ![]() NH3(l) △H=(b+c-a)kJ/mol
NH3(l) △H=(b+c-a)kJ/mol
D. 1/2 N2(g)+3/2H2(g) ![]() NH3(g) △H=(a+b)kJ/mol
NH3(g) △H=(a+b)kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com