
����Ŀ��Ϊ�о�ͭ��Ũ����ķ�Ӧ��ij��ѧ��ȤС���������ʵ�飮
ʵ��I����Ӧ����Ķ���̽��������ͼװ�ã��̶�װ������ȥ������ʵ��

(1)Aװ�õ��Թ��з�����Ӧ�Ļ�ѧ����ʽ��_____________________��Fװ�õ��ձ��з�����Ӧ�����ӷ���ʽ��__________________________��Bװ���е�������_________��
(2)ʵ������У���֤��Ũ��������Ԫ�ص�������ǿ����Ԫ�ص�������______________ ��
(3)ʵ�����ʱ����ȥ���оƾ���֮ǰ������ɵ�ʵ�������_________________��
(4)ʵ�������֤��Aװ���Թ��з�Ӧ���ò����Ƿ���ͭ���ӣ��轫��Һϡ�ͣ�����������________________________________��
ʵ���Ӧ����Ķ���̽��
(5)��ͭ��Ũ���ᷴӦ�Ĺ����У������к�ɫ���ʳ��֣��Һ�ɫ����ΪCu2S������Cu2S�ķ�ӦΪaCu+bH2SO4 ![]() cCu2S+dCuSO4+e H2O����a��b=______________��
cCu2S+dCuSO4+e H2O����a��b=______________��
(6)Ϊ�ⶨ����ͭ�IJ��ʣ����÷�Ӧ������Һ�кͺ����Ƴ�250.00mL��Һ��ȡ����Һ25.00mL��������KI��Һ�������ɵ�I2ǡ����20.00mL 0.30molL��1��Na2S2O3��Һ��Ӧ������Ӧ����ͭ������Ϊ6.4g��������ͭ�IJ���Ϊ_________________������֪2Cu2++4I��=2CuI+I2�� 2S2O32��+I2=S4O62��+2I���� ��ע������ͭ�IJ���ָ��������ͭ��ʵ�ʲ��������۲����ı�ֵ��
���𰸡� Cu+2H2SO4��Ũ��![]() CuSO4+SO2��+2H2O SO2+2OH��=SO32��+H2O ��ɫ��ĩ����ɫ Dװ���к�ɫ������ɫ�ޱ仯��Eװ������Һ��ɫ ����ͭ˿���ر�K1 �� K2 ��Aװ������ȴ�Ļ����Һ���ձ��ڱڻ�������ʢˮ���ձ��У������Ͻ��裬�۲��Ƿ�����ɫ���� 5��4 60%
CuSO4+SO2��+2H2O SO2+2OH��=SO32��+H2O ��ɫ��ĩ����ɫ Dװ���к�ɫ������ɫ�ޱ仯��Eװ������Һ��ɫ ����ͭ˿���ر�K1 �� K2 ��Aװ������ȴ�Ļ����Һ���ձ��ڱڻ�������ʢˮ���ձ��У������Ͻ��裬�۲��Ƿ�����ɫ���� 5��4 60%
��������
��1��Aװ�õ��Թ���ͭ��Ũ���ᷢ����Ӧ�Ļ�ѧ����ʽ��Cu+2H2SO4��Ũ��![]() CuSO4+SO2��+2H2O�������������������������NaOH��Ӧ�����������ƺ�ˮ�����ӷ�Ӧ����ʽΪSO2+2OH-=SO32-+H2O��ˮ���лӷ��ԣ������¶ȴٽ���ӷ����������ɵ������к���ˮ������ˮ������ʹ��ˮ����ͭ�ɰ�ɫ��Ϊ��ɫ������Bװ���е������ǣ���ɫ��ĩ����ɫ��
CuSO4+SO2��+2H2O�������������������������NaOH��Ӧ�����������ƺ�ˮ�����ӷ�Ӧ����ʽΪSO2+2OH-=SO32-+H2O��ˮ���лӷ��ԣ������¶ȴٽ���ӷ����������ɵ������к���ˮ������ˮ������ʹ��ˮ����ͭ�ɰ�ɫ��Ϊ��ɫ������Bװ���е������ǣ���ɫ��ĩ����ɫ��
��2��֤��Ũ��������Ԫ�ص�������ǿ����Ԫ�أ�����Ԫ�ػ��ϼ۱仯���ɵIJ�������жϣ�������������Dװ�û��ɫ�仯Ϊ��ɫ�������ɶ�������Eװ����Ʒ�����ɫ������֤��Ũ��������Ԫ�ص�������ǿ����Ԫ�ص�ʵ�������ǣ�Dװ��������ͭ��ɫ���仯��˵�����������ɣ�Eװ����Ʒ����Һ��ɫ˵�������˶����������壻
��3��ʵ�����ʱ������ͭ˿����ȥ���оƾ���֮ǰ������ɵ�ʵ������ǹر�K1��K2����ֹCE�е���Һ������ը�Ѳ����ܣ�
��4����֤���ɵ���Һ�к���ͭ���ӣ���Ҫ���Թ��е�Һ�嵹��ˮ���ܽ⣬�۲��Ƿ������ɫ��Һ����Aװ������ȴ�Ļ����Һ���ձ��ڱڻ�������ʢˮ���ձ��У������Ͻ��裬������ɫ��Һ֤������ͭ���ӣ�
��5��aCu+bH2SO4![]() cCu2S+dCuSO4+eH2O��CuԪ�ػ��ϼ���0�۱�Ϊ+1�ۡ�+2�ۡ�SԪ�ػ��ϼ���+6�۱�Ϊ-2�ۣ�ת�Ƶ�����Ϊ6������ת�Ƶ����غ㼰ԭ���غ���ƽ����ʽΪ5Cu+4H2SO4
cCu2S+dCuSO4+eH2O��CuԪ�ػ��ϼ���0�۱�Ϊ+1�ۡ�+2�ۡ�SԪ�ػ��ϼ���+6�۱�Ϊ-2�ۣ�ת�Ƶ�����Ϊ6������ת�Ƶ����غ㼰ԭ���غ���ƽ����ʽΪ5Cu+4H2SO4![]() Cu2S+3CuSO4+4H2O������a�Ub=5�U4��
Cu2S+3CuSO4+4H2O������a�Ub=5�U4��
��6������2Cu2++4I-=2CuI+I2��2S2O32-+I2=S4O62-+2I-��2Cu2+��I2��2S2O32-��
���Ƶõ���Һ������ͭ�����ʵ���Ũ��Ϊxmol/L��
2Cu2+��I2��2S2O32-��
2mol2mol
0.025xmol ��0.3��0.02��mol
2molL�U2mol=0.025xmol�U��0.3��0.02��mol
x=![]() =0.24��
=0.24��
��250mL��Һ��n��Cu2+��=0.24mol/L��0.25L=0.06mol���μӷ�Ӧ��n��Cu��=![]() =0.1mol��
=0.1mol��
������ͭ�IJ���=![]() ��100%=60%��
��100%=60%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ϊ��ɫ��ĩ״���壬�������´ɵ����ż�����ɫ�����մɺͲ��������ϡ�Ҳ����������Ԫ�����ϡ����������ز��ϡ���ҵ�Ͽ�ͨ���������ַ�����ȡ
NiCO3![]() NiO+CO2�� Ni(NO3)2��6H2O
NiO+CO2�� Ni(NO3)2��6H2O ![]() NiO+2HNO3+4H2O��
NiO+2HNO3+4H2O��
�ش���������
��1����Ԫ����Ԫ�����ڱ��е�λ��Ϊ__________����۵��ӹ������ʽΪ____________________��
��2������������Ӧ�漰�ķǽ���Ԫ���е�һ����������Ԫ��Ϊ_________����ԭ�Ӻ���δ�ɶԵ�������__________��
��3������������Ӧ���ɵķǽ���������е�ϸߵ���_______������Ҫԭ����_________________��
��4��NO3-���ӵĿռ乹����___________��������ԭ�ӵ��ӻ���ʽΪ___________��
��5������������ṹ���Ȼ������ƣ��侧���ṹ����ͼ���ṹ�������Ӳ��������������ܶѻ��������ӵĶѻ���ʽ��______________��

��6�����ײ��ϵı���ԭ��ռ��ԭ�����ı��������������������������ʵ�ԭ����ij�������������ӵ���״Ϊ�����壬��߳�������������������ͼ����5���������������ı���ԭ������ԭ�����ı�Ϊ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ͭ�Ľ��������Ա������������ں����������������ͭ���Լ����丯ʴ
B. ����Ӧ�����жϿ���ѧ���ų������������γɻ�ѧ�������յ���������Ӧ����
C. һ���¶��£�����Ӧ2BaO2(s)![]() 2BaO(s)+O2(g)�����������ƽ�ⲻ�ƶ�
2BaO(s)+O2(g)�����������ƽ�ⲻ�ƶ�
D. ��ӦCO2(g)��H2(g)![]() CO(g)��H2O(g)�� ��H>0���Է����У���֪�÷�Ӧ��S>0
CO(g)��H2O(g)�� ��H>0���Է����У���֪�÷�Ӧ��S>0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NH3��һ����Ҫ�Ļ���ԭ�ϣ������Ʊ�һϵ������(��ͼ)������˵����ȷ����
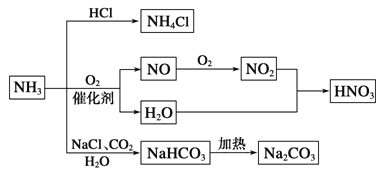
A. NH4Cl��NaHCO3���dz��õĻ���
B. NH4Cl��HNO3��Na2CO3����ʱ���ֽ�
C. NH3��NO2��һ�������¿ɷ���������ԭ��Ӧ
D. ͼ�����漰�ķ�Ӧ��Ϊ������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ƕ�������ɺ������о������룬���ʵķ���Ҳ���Ӷ������������й�˵����ȷ����
A. H2SO4��NaOH��NaNO3����ǿ�����
B. Na2O��Al2O3��Fe2O3���Ǽ���������
C. ������С�մ��ǻ����
D. �ռ�����ʯ�Ҷ��Ǽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Al(NO3)3 ������![]() ����ȡ������Al(NO3)3 ���ȵ�ʵ�鲽������ͼ��ʾ������˵����ȷ���ǣ� ��
����ȡ������Al(NO3)3 ���ȵ�ʵ�鲽������ͼ��ʾ������˵����ȷ���ǣ� ��

A. ����Al(NO3)3 ��Һ��Ҫ�IJ�������ֻ��250 mL����ƿ��������
B. �����Լ�a������Ӧ�����ӷ���ʽΪAl3++3OH����Al(OH)3��
C. ������b ����Ҫ���������н���
D. Al(OH)3�Ĵ���Ϊ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����м��������500��600 �� �¿���ȡ��ˮFeCl3 ��ʵ��װ������ͼ������˵����ȷ���ǣ� ��

A. ��Һ©����ʢ�ŵ��Լ���ϡ����
B. ʵ��ʱӦ�ȵ�ȼI �оƾ��ƣ��ٵ�ȼ���оƾ���
C. ϴ��ƿ��ʢ�ŵ��Լ��DZ���ʳ��ˮ
D. �ձ���ʢ�ŵ��Լ��dz���ʯ��ˮ��Ŀ��������β��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ��ѡ��3�����ʽṹ�����ʡ�
�ѱ���Ϊ��������֮��ĵ����������Ʊ������ѵ�һ���������£�

�ش��������⣺
��1����̬��ԭ�ӵļ۵����Ų�ͼΪ ����ԭ�Ӻ���� ���˶�״̬����ͬ�ĵ��ӡ������Ѿ�������ͼ1��ʾ��Ϊ �ѻ�����ѻ���ʽ����
��2�����ݼ۲���ӻ������ۣ��۲���Ӷ�֮��ij�����С������˳��l��l >> l��b > b��b��lΪ�¶Ե��Ӷԣ�bΪ���ϵ��Ӷԣ��������H2O�е�H��O��H���ǿɵó��Ľ�����________��
A��180�� | B���ӽ�120������С��120�� |
C���ӽ�120����������120�� | D���ӽ�109��28������С��109��28�� |
��3����֪TiCl4��ͨ�����������ɫҺ�壬�۵�Ϊ�C37�����е�Ϊ136������֪TiCl4Ϊ________���塣
��4������TiO2��һ��Ӧ�ù㷺�Ĵ����������һ��ʵ������ͼ2���������ҵķе����Ը��ڻ�����ף���Ҫԭ���� �����������в�ȡsp3�ӻ���ԭ�ӵĵ�һ�������ɴ�С��˳��Ϊ ��

��5�����ѿ���Ľṹ����ͼ��ʾ��������λ�����������ĽǶ����� �������Ӱ�Χ����λ�����壻������λ���������������ģ��� �������Ӱ�Χ�����ѿ���Ļ�ѧʽΪ �����þ����ı߳�Ϊa pm������ѿ�����ܶ�Ϊ g.cm-3��ֻҪ������ʽ�����ؼ������ֵ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��װ�ý�����Ӧʵ�飬�ܴﵽʵ��Ŀ�ĵ��ǣ� ��

A. ��ͼ1��ʾװ������FeCl3��Һ�Ƶ���ˮFeCl3
B. ��ͼ2��ʾװ�ô�Fe(OH)3�����й��˳�Fe(OH)3����
C. ��ͼ3��ʾװ�ô�CH3OH��C2H5OH�Ļ�����з�����Ҵ�
D. ��ͼ4��ʾװ�ô�CH3COOH��CH3COOC2H5�Ļ�����з������������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com