
����Ŀ������˵����ȷ����
A. ͭ�Ľ��������Ա������������ں����������������ͭ���Լ����丯ʴ
B. ����Ӧ�����жϿ���ѧ���ų������������γɻ�ѧ�������յ���������Ӧ����
C. һ���¶��£�����Ӧ2BaO2(s)![]() 2BaO(s)+O2(g)�����������ƽ�ⲻ�ƶ�
2BaO(s)+O2(g)�����������ƽ�ⲻ�ƶ�
D. ��ӦCO2(g)��H2(g)![]() CO(g)��H2O(g)�� ��H>0���Է����У���֪�÷�Ӧ��S>0
CO(g)��H2O(g)�� ��H>0���Է����У���֪�÷�Ӧ��S>0
���𰸡�D
��������A��Cu��Fe�γ�ԭ���ʱ��ͭ�Ľ��������Ա�����������������������ʴ�����Բ����ں����������������ͭ���Լ����丯ʴ����A����B������ѧ�����жϿ���ѧ���ų������������γɻ�ѧ�������յ����������H=�ϼ����յ�����-�ɼ��ų���������0����Ӧ���ȣ���B����C��һ���¶��£�����Ӧ2BaO2(s)2BaO(s)+O2(g)�������������Сѹǿ��ƽ�������ƶ�����C����D��TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)��һ�������¿��Է����У����G=��H-T��S��0���ָ÷�Ӧ��һ�����ȷ�Ӧ�����ԡ�S��0����D��ȷ����ѡD��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W��Q����Ԫ�ص�ԭ���������������ҷֱ�λ�����ڱ��Ķ������������ڣ�X��Y��ԭ���������1����̬Yԭ������3��δ�ɶԵ��ӣ���̬Z2-���̬W+�ĵ��Ӳ�ṹ��ͬ��WΪǰ�����ڵ縺����С��Ԫ�أ�Qλ�����ڱ��ĵ�12�С�
��ش��������⣺
(1)����һ���ռ��˶�״̬�ĵ�����ԭ�Ӻ�����ֵĸ����ܶȷֲ�����___________����������
(2)��̬X ԭ�ӵļ۲�����Ų�ͼΪ____________����̬Wԭ������___________�����������෴�ĵ��ӡ�
(3)��̬Yԭ�Ӻͻ�̬Zԭ�ӵĵ�һ�����ܣ�Y___________���>����<")Z��
(4)Fe3+����X��Y��Z��W��ɵ�һ�ֻ�������顣��û������е������ӻ�Ϊ�ȵ�����ġ��ַ���Ϊ__________�������ʽ����
(5)Y����ۺ���������У�����ԭ�ӵ��ӻ��������Ϊ__________����������ӵĿռ乹��Ϊ______��
(6)��ͬѹǿ�£�Y������⻯����۵����W���⻯����۵㣬ԭ��Ϊ_______________��
(7)Z��Q�γɵ�һ�־���ľ�����ͼ��ʾ��Z����λ��Ϊ_____________���������ܶ�Ϊ��g��cm-1�������ӵ�������ֵΪNA��������Ϊ____________nm(�ú��ѡ�NA�Ĵ���ʽ��ʾ)��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������,�����ڽ�����ͬ���ʵ���
A.��չ��B.������C.���۵�D.��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڹ۲������ϸ���зֲ����Լ���
A. ����Լ� B. ˫�����Լ�
C. �յ���ȾҺ D. ���졢����Ⱦɫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������2003�꣬�ҹ��ͼ����ɹ����䡰������š����˷ɴ�����Ϊ��������������̫�յĹ��ң����亽��ɴ����õĸ���ȼ�����£�N2H4����
��1������ƽ�����ʢ��ǿ��ԭ��Һ̬�º�ǿ������Һ̬˫��ˮ����֪�·�����ÿ��ԭ�ӵ��������Ӷ��ﵽ���ȶ��ṹ����д���µĽṹ��ʽ��________����18O��16O��H��Dԭ����ɵ�H2O2���ӹ���____�֡�
��2����-����ȼ�ϵ����һ�ֻ����ļ���ȼ�ϵ�أ��������Һ��20%��30%��KOH��Һ����-����ȼ�ϵ�طŵ�ʱ�����ĵ缫��Ӧʽ��________��
��3����ͳ�Ʊ��µķ���������NaClO����NH3���Ƶ��µ�ϡ��Һ.�÷�Ӧ�����ӷ���ʽ��__________��
��4����֪lg������ȫȼ������ˮ����ʱ�ų�����121kJ����������lmol O=O����ȫ����ʱ��������496kJ,ˮ������lmolH-O���γ�ʱ�ų�����463kJ,��������1molH-H������ʱ��������Ϊ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˳�ȥ���������л��е�����������ѡ�Լ��Ͳ�������������
A.����,����B.����,����
C.NaOH��Һ,����D.NaOH��Һ,����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���¹���ѧ�ҿ�������Ϊ������������6��̼ԭ���Ե�˫��������϶��ɵĻ�״�ṹ.Ϊ����֤�������йر����Ĺ۵㣬��ͬѧ�������ͼʵ�鷽����

�ٰ���ͼ��ʾ��װ��ͼ���Ӻø�������
�ڼ���װ�õ������ԣ�
����A�м��������ı���Һ��Ļ��Һ�壬�ټ����������ۣ�������Ƥ������ֹˮ��K1��K2��K3��
�ܴ�C����ƿ�ռ������������b���¶˲����ձ����ˮ�У���ѹ�A��װ��ˮ�Ľ�ͷ�ιܵĽ�ͷ���۲�ʵ������
��ش��������⡣
��1��A����������Ӧ�ķ�Ӧ����ʽΪ_______����֤�������չ۵�����ʵ��������________��
��2��װ��B��������________��
��3��C����ƿ���ݻ�Ϊ500mL���ռ�����ʱ�����ڿ���δ�ž�������ˮδ������ƿ��������ƿ�л�������H2������ܶ�Ϊ37.9����ʵ�����ʱ��������ƿ�е�ˮ�����Ϊ_____ mL (������ƽ����Է�������Ϊ29����
��4����֪����Ľṹ��ʽΪ![]() ���Իش�
���Իش�
����������к���______��_______���ֹ����ţ�д���ƣ���
�����������������Һ��Ӧ�Ļ�ѧ����ʽ��______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�о�ͭ��Ũ����ķ�Ӧ��ij��ѧ��ȤС���������ʵ�飮
ʵ��I����Ӧ����Ķ���̽��������ͼװ�ã��̶�װ������ȥ������ʵ��

(1)Aװ�õ��Թ��з�����Ӧ�Ļ�ѧ����ʽ��_____________________��Fװ�õ��ձ��з�����Ӧ�����ӷ���ʽ��__________________________��Bװ���е�������_________��
(2)ʵ������У���֤��Ũ��������Ԫ�ص�������ǿ����Ԫ�ص�������______________ ��
(3)ʵ�����ʱ����ȥ���оƾ���֮ǰ������ɵ�ʵ�������_________________��
(4)ʵ�������֤��Aװ���Թ��з�Ӧ���ò����Ƿ���ͭ���ӣ��轫��Һϡ�ͣ�����������________________________________��
ʵ���Ӧ����Ķ���̽��
(5)��ͭ��Ũ���ᷴӦ�Ĺ����У������к�ɫ���ʳ��֣��Һ�ɫ����ΪCu2S������Cu2S�ķ�ӦΪaCu+bH2SO4 ![]() cCu2S+dCuSO4+e H2O����a��b=______________��
cCu2S+dCuSO4+e H2O����a��b=______________��
(6)Ϊ�ⶨ����ͭ�IJ��ʣ����÷�Ӧ������Һ�кͺ����Ƴ�250.00mL��Һ��ȡ����Һ25.00mL��������KI��Һ�������ɵ�I2ǡ����20.00mL 0.30molL��1��Na2S2O3��Һ��Ӧ������Ӧ����ͭ������Ϊ6.4g��������ͭ�IJ���Ϊ_________________������֪2Cu2++4I��=2CuI+I2�� 2S2O32��+I2=S4O62��+2I���� ��ע������ͭ�IJ���ָ��������ͭ��ʵ�ʲ��������۲����ı�ֵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ֽ�̫���ܹ����ҵ���չ���ƶ��˸ߴ����������Ӧ�á��ش��������⣺
��ҵ���á������ӷ����Թ�ʯ��SiO2��Ϊԭ���Ʊ�ұ�ߴ���Ĺ�����������ͼ��ʾ��

��֪��SiHCl3 ������Ϊ�ӷ�����ˮ�����ɫҺ�塣
��1������ԭ��������Ҫ�ڸ��������£��÷�Ӧ����Ҫ��ԭ����Ϊ_____________��
��2�������������̷�Ӧ�¶�Ϊ200��300�棬�÷�Ӧ�Ļ�ѧ����ʽΪ__________��
��3�����������������롱�롰�Ƚ⡱�Ĺ��̾���Ҫ����ˮ�������������£�ԭ����_________________��
��4���������������п�ѭ��ʹ�õ�������_________��________���ѧʽ����
��ұ�ߴ����г�������������Ԫ�أ�����������ȣ��������вⶨ�����ӣ��Խ�һ����߹�Ĵ��ȡ�
��5���ⶨұ�ߴ�������Ԫ�غ���
��m g ��Ʒ�������������ܽ�������V mL ��Һ�����ǰ���NH2OH���ѵ��룩��Fe3+��ԭΪFe2+��������ӷƣ��γɺ�ɫ���ʡ���������ȷ���������A Ϊ0.500�������A��Fe2+Ũ�ȶ�Ӧ������ͼ����

�� ���������£��ǰ���Fe3+��ԭΪFe2+��ͬʱ����һ������Ⱦ���壬�÷�Ӧ�����ӷ���ʽΪ__________________________________��
�� ��Ʒ����Ԫ�ص�������������ʽΪ____________________������ĸ��ʾ����
��6�����������ӷ�����ұ�ߴ����е���Ԫ��
����Ar�������棬�ֱ����O2��CO2���о���Ԫ�ص�ȥ���ʺ�Ԫ�ص���ʧ�ʣ�ʵ��������ͼ��ʾ����ʵ���������̣�Ӧ����O2��CO2�ĺ���������ԭ����________________��
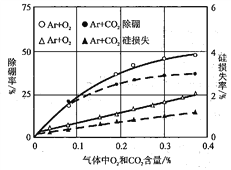
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com