
分析 (1)Si的原子核外有14个电子分三层排布;
(2)SiC中每个C原子形成4个共价键,价层电子对数为4;非金属原子之间形成的化学键为共价键;
(3)根据电子数相等计算M原子电子数,根据原子中电子数=原子序数确定元素;根据离子晶体的熔点与晶格能成正比,晶格能与离子半径成反比;
解答 解:(1)Si的原子核外有14个电子分三层排布,则其电子排布式为1s22s22p63s23p2;
故答案为:1s22s22p63s23p2;
(3)SiC中每个C原子形成4个共价键,价层电子对数为4,则C原子的杂化方式为sp3;SiC中C原子与Si原子之间以共价键结合;
故答案为:sp3;共价键;
(3)氧化物MO的电子总数与SiC的相等,则M原子中电子数为12,原子中电子数=原子序数=12,所以M为Mg元素;MgO和CaO都是离子晶体,镁离子半径小于钙离子,且二者所带电荷相等,所以MgO的晶格能大于CaO,所以MgO的熔点高于CaO;
故答案为:Mg;Mg 2+半径比Ca 2+小,MgO的晶格能大;
点评 本题考查较综合,涉及原子杂化方式的判断、晶格能等知识点,根据存在的σ键个数确定原子杂化方式,根据离子晶体熔点与晶格能、离子半径的关系来分析解答,题目难度不大.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 2A+3B=2C | B. | A+3B=2C | C. | 3A+B=2C | D. | 3A+2B=3C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
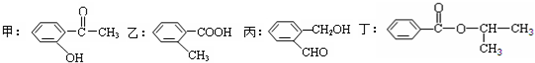
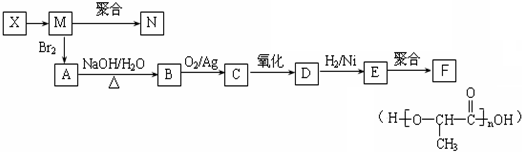
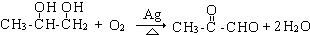 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,33.6L氯气与56g铁充分反应,转移电子数为3NA | |
| B. | 常温常压下,22.4L丙烷中共价键数目为10NA | |
| C. | 通常状况下,2.24LNO2和N2O4的混合气体中氮原子和氧原子数比为1:2 | |
| D. | 1mol L-1的Na2CO3溶液中所含阴离子数大于NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠是银白色金属,熔点低,硬度大 | |
| B. | 钠放置于空气中,会迅速被氧化而生成淡黄色的氧化钠 | |
| C. | 在氧气中加热时,金属钠剧烈燃烧,黄色火焰 | |
| D. | 金属钠着火可以用水灭火 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com