
右图烧杯中均盛装的是海水,则下列说法正确的是

A.①中的铁受腐蚀最慢
B.④中的铁受腐蚀最快
C.②中C是正极,铁发生析氢腐蚀
D.③中会有红棕色沉淀产生
科目:高中化学 来源: 题型:
下列关于化学平衡常数K的说法中正确的是
A.平衡常数的大小与起始浓度有关 B.K值越大,反应的转化率越小
C.K值越大,反应的转化率越大 D.温度越高,K值越大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是:( )
A.元素的单质一定是由还原该元素的化合物来制得
B.含有最高价元素的化合物不一定具有很强的氧化性
C.阳离子只能得到电子被还原,阴离子只能失去电子被氧化
D.在化学反应中,得电子越多的氧化剂,其氧化性就越强
查看答案和解析>>
科目:高中化学 来源: 题型:
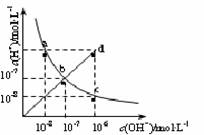
25℃时,水溶液中c(H+)与c(OH-)的变化关系如图中曲线a c所示,下列判断错误的是
A.a c曲线上的任意一点都有c(H+)·c(OH-)=10-14
B.b d线段上任意一点对应的溶液都呈中性
C.d点对应溶液的温度高于25℃,pH<7
D.CH3COONa溶液不可能位于c点
查看答案和解析>>
科目:高中化学 来源: 题型:
 化学—物质结构与性质(15分)
化学—物质结构与性质(15分)
乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
(1)CaC2与水反应生成乙炔的反应方程式为________.
(2)比较第二周期元素C、N、O三种元素的第一电离能从大到小顺序为 ______(用元素符号表示),用原子结构观点加以解释______。
(3)CaC中C22-与O22+互为等电子体,O22+的电子式可表示为______;1molO22+中含有的Π键数目为_______。
(4)CaC2晶体的晶胞结构与NaCI晶体的相似(如图所示),
但CaC2晶体中含有的中哑铃形C22-的存在,使晶胞沿一个
方向拉长。CaC2晶体中1个Ca2+周围距离最近的C22-
数目为______。
(5)将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀。
Cu+基态核外电子排布式为 _______。
(6)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈
分子中碳原子轨道杂化类型是______;分子中处于同一
直线上的原子数目最多为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
对于右图的锌锰电池,下列说法正确的是
A.MnO2是氧化剂,被氧化
B.碳棒为正极、锌筒为负极
C.放电过程中NH4+向锌极移动
D.负极反应为:Zn-2e-+2OH-==Zn(OH)2

查看答案和解析>>
科目:高中化学 来源: 题型:
工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g) CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
 请回答下列问题:
请回答下列问题:
(1)在“图1”中,曲线 (填:a或b)表示使用了催化剂;该反应属于 (填:吸热、放热)反 应。
应。
(2)下列说法正确的是
A.该反应的反应热为:△H= 91kJ·mol-1 B.起始充入的CO为2mol
C.容器中压强恒定时,反应已达平衡状态 D..增加CO浓度,CO的转化率增大
E.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时 会减小
会减小
(3)从反应开始到建成平衡, v(H2)=________;请在“图3”中画出甲醇百分含量随温度T变化的P2曲线,且P1<P2。
(4)以甲醇、空气为主要原料,KOH溶液为电解质溶液,铂为电极构成燃料电池。则该电池中负极上的电极反应式为 。
(5)已知在常温常压下:
①H2O(g) = H2O(l) ΔH1=-44.0 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2=-566.0 kJ/mol
③2CH3OH(l) + 3O2(g) = 2CO2 (g) + 4H2O(g) ΔH3=-1275.6 kJ/mol
(g) + 4H2O(g) ΔH3=-1275.6 kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
含20.0 g NaOH的稀溶液与稀盐酸完全反应时,放出28.7 kJ的热量,表示该反应的热化学方程式正确的是
A.NaOH(aq)+HCl(aq)=NaCl(aq)+H20(l)  = +28.7 kJ·mol-1
= +28.7 kJ·mol-1
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H20(l)  = -28.7 kJ·mol-1
= -28.7 kJ·mol-1
C.NaOH(aq)+HCl(aq)=NaCl(aq)+H20(l)  = +57.4 kJ·mol-1
= +57.4 kJ·mol-1
D.NaOH(aq)+HCl(aq)=NaCl(aq)+H20(l)  = -57.4 kJ·mol-1
= -57.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A、碳酸铵分解是吸热反应,根据焓判据判断能自发分解
B、多次洗牌以后,扑克牌的毫无规律的混乱排列的几率大,越混乱,熵值越大
C、水总是自发地由高处往低处流,这是一个自发反应
D、室温下水结成冰是自发过程
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com