
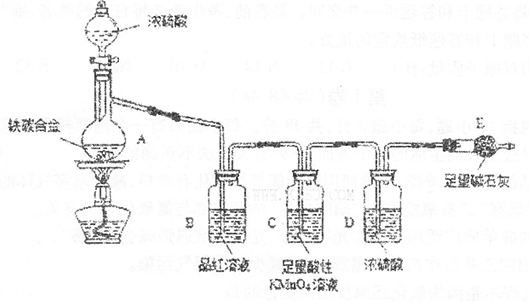
 CuSO2+ SO2↑+2H2O; (2分) 酸性和强氧化性(2分)
CuSO2+ SO2↑+2H2O; (2分) 酸性和强氧化性(2分)

科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
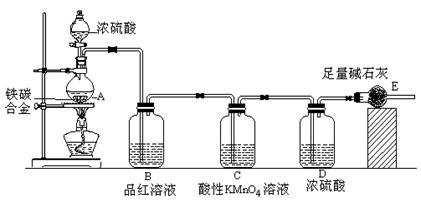
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
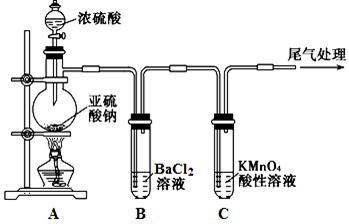
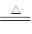 Na2SO4+SO2↑+H2O
Na2SO4+SO2↑+H2O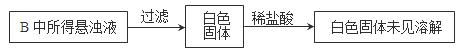
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在蔗糖中加入浓硫酸后,出现发黑现象,说明浓硫酸具有脱水性 |
| B.浓硝酸在光照下颜色变黄,说明浓硝酸不稳定 |
| C.常温下,浓硝酸可以用铝罐运输,说明铝与浓硝酸常温下不反应 |
| D.反应CuSO4+H2S=CuS↓+H2SO4能进行,说明CuS既不溶于水,也不溶于稀硫酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
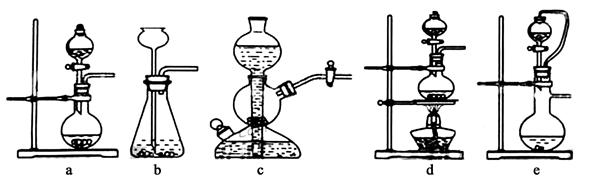
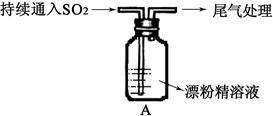
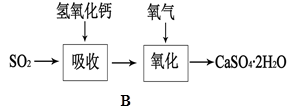
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
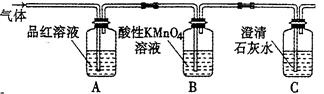
 CO2↑+2SO2↑+2H2O,其中浓H2 S04所起的作用是 (填“氧化剂”或“还原剂”)。若有0.2mol碳的完全反应,则消耗H2S04的质量是 g,标况下产生SO2的体积为______________L。
CO2↑+2SO2↑+2H2O,其中浓H2 S04所起的作用是 (填“氧化剂”或“还原剂”)。若有0.2mol碳的完全反应,则消耗H2S04的质量是 g,标况下产生SO2的体积为______________L。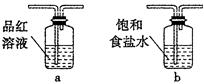
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com