
【题目】海洋是一个巨大的化学资源宝库。 海水综合利用的部分流程如下:

已知:Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。
(1)电解饱和 NaCl 溶液的化学方程式为_____________________________________。粗盐中常含 Ca2+、Mg2+、SO42-等杂质离子,可依次加入NaOH、___________、___________、盐酸试剂来进行提纯。
(2)下列方法不可用于海水淡化的是________(填字母代号)。
A. 蒸馏法 B. 萃取法 C. 离子交换法 D. 电渗析法
(3)工业上用电解法制Mg 时,通常在MgCl2中加入适量 CaCl2,其原因是:①___________; ②增加电解质的密度,便于分离出熔融的镁。
(4) 利用右图所示装置从母液中提取溴,在 B 瓶中得到较浓的溴水。实验方案为:关闭b、d,打开a、c,由a 向A中缓慢通入________至反应完全;关闭a、c,打开b、d、e,由b向A中鼓入足量__________, 同时由 e 向 B 中通入足量_________;关闭b、e,打开a,再由a 向B中缓缓鼓入足量___________ (实验中须使用的试剂有:SO2、Cl2、热空气) 。

【答案】 2NaCl + 2H2O ![]() Cl2↑ + H2↑ + 2NaOH BaCl2 Na2CO3 B 使 MgCl2 熔融温度降低, 从而减少能量消耗 Cl2 热空气 SO2 Cl2
Cl2↑ + H2↑ + 2NaOH BaCl2 Na2CO3 B 使 MgCl2 熔融温度降低, 从而减少能量消耗 Cl2 热空气 SO2 Cl2
【解析】(1)惰性电极电解NaCl溶液,阳极上是氯离子失电子,2Cl--2e-=Cl2↑,阴极上是氢离子得电子,2H++2e-=H2↑,由两极上的电极反应可以得到总反应为2Cl-+2H2O![]() H2↑+Cl2↑+2OH-,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,则试剂可依次加入NaOH、BaCl2、Na2CO3、HCl;
H2↑+Cl2↑+2OH-,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,则试剂可依次加入NaOH、BaCl2、Na2CO3、HCl;
(2)A.蒸馏法,是把水从水的混合物中分离出来,得到纯净的水,故A正确;B.萃取法,对于微溶于水的有机物,可用萃取法,水中没有微溶于水的有机物,故B错误;C.通过离子交换树脂可以除去海水中的离子,从而达到淡化海水的目的,故C正确;D.利用电渗析法可使相应的离子通过半透膜以达到硬水软化的效果,故D正确;故答案为B;
(3)离子浓度越大其熔融盐的导电性越强,在MgCl2中加入CaCl2,进行电解,增大离子浓度,从而增大熔融盐的导电性,使氯化镁熔融温度降低,从而减少冶炼过程中的能量消耗;
(4)A中海水用硫酸酸化,关闭a、c,打开b、d、e,由b向A中通入热空气和氯气,发生氧化还原反应生成溴,空气将溴吹出,同时由e向B中通入足量SO2,发生Br2+SO2+H2O═2HBr+H2SO4,富集后再关闭b、e,打开a,再由a向B中缓慢通入足量Cl2,生成Br2。


科目:高中化学 来源: 题型:
【题目】华夏文明源远流长,以下说法从化学视角理解错误的是
A. “日照澄洲江雾开,淘金女伴满江隈”,诗中包含了丁达尔现象
B. “甘之如饴”, 说明糖类均有甜味
C. “凡石灰,经火焚炼为用”, 这段记载中涉及分解反应
D. “百宝都从海舶来,玻璃大镜比门排”,制玻璃的某成分可用于制造光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,若电解5min时,铜电极质量增加21.6g。
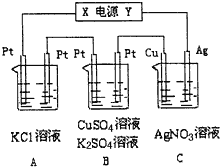
(1)电源电极Y名称为__________(填“正极”或“负极” )。
(2)电解池中溶液的pH变化:A_________,B________(填“增大”、“减小”或“不变”)。
(3)A中发生反应的离子方程式为:_________________,若A中KCl溶液的体积也是200mL,电解后溶液OH-的浓度等于_______。
(4)B中阳极的电极反应式为____________________;若通电5min时B中共收集2.24L气体(标况),溶液体积为200mL,则通电前硫酸铜溶液的物质的量浓度约为______。
(5)若将C装置单独取出,导线连接铜、银后,请写出负极的电极反应式____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用 H2 和钠反应制备氢化钠的装置如右图所示(Zn 粒中含有少量 ZnS 杂质),下列说法不正确的是

A. ①、 ②中依次盛有浓 NaOH 溶液、 浓 H2SO4
B. 管式炉加热前, 用试管收集③处气体并点燃, 通过声音判断气体纯度
C. 结束反应时, 先停止管式炉加热, 再关闭活塞 K
D. 取出瓷舟内的固体, 投入适量水中, 若有气体产生, 即可证明制得了氢化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主族元素X、Y,已知X的质子数为a,X2+比Y2-核外少8个电子,若Y原子的质量数为b,则Y原子核内中子数为( )
A. b-a-4 B. b-a-8 C. b+a+8 D. b-a-12
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com