
【题目】如图所示,若电解5min时,铜电极质量增加21.6g。
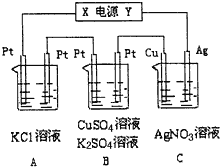
(1)电源电极Y名称为__________(填“正极”或“负极” )。
(2)电解池中溶液的pH变化:A_________,B________(填“增大”、“减小”或“不变”)。
(3)A中发生反应的离子方程式为:_________________,若A中KCl溶液的体积也是200mL,电解后溶液OH-的浓度等于_______。
(4)B中阳极的电极反应式为____________________;若通电5min时B中共收集2.24L气体(标况),溶液体积为200mL,则通电前硫酸铜溶液的物质的量浓度约为______。
(5)若将C装置单独取出,导线连接铜、银后,请写出负极的电极反应式____________
【答案】 正极 增大 减小 2Cl-+2H2O=2 OH-+H2+Cl2 1mol/L 4OH--4e-=2H2O +O2 0.25 mol/L Cu-2e-=Cu2+
【解析】(1)由已知铜电极的质量增加,所以铜电极上发生还原反应,铜电极为阴极,则Ag电极为阳极,电源中Y极是正极。
(2)A为惰性电极电解KCl溶液,总反应为:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-,故电解后A中溶液pH增大;装置B为惰性电极电解硫酸铜溶液,初始阶段总反应的离子方程式为2Cu2++2H2O
Cl2↑+H2↑+2OH-,故电解后A中溶液pH增大;装置B为惰性电极电解硫酸铜溶液,初始阶段总反应的离子方程式为2Cu2++2H2O![]() 2Cu+O2↑+4H+,故电解后B中溶液pH减小。
2Cu+O2↑+4H+,故电解后B中溶液pH减小。
(3)由上述分析,A中发生反应的离子方程式为:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-;因为C中铜电极反应为:Ag++e-=Ag,电解5 min时,铜电极增加21.6 g,即生成的Ag为0.2mol,所以电路中转移0.2mol电子,又根据A中反应2H2O+2e-=H2↑+2OH-,则生成OH-物质的量为0.2mol,电解后溶液OH-的浓度为:0.2mol÷0.2L=1molL-1。
Cl2↑+H2↑+2OH-;因为C中铜电极反应为:Ag++e-=Ag,电解5 min时,铜电极增加21.6 g,即生成的Ag为0.2mol,所以电路中转移0.2mol电子,又根据A中反应2H2O+2e-=H2↑+2OH-,则生成OH-物质的量为0.2mol,电解后溶液OH-的浓度为:0.2mol÷0.2L=1molL-1。
(4)装置B为惰性电极电解硫酸铜溶液,所以阳极的电极反应式为:4OH--4e-=2H2O+O2↑;根据前面的分析,电路中转移0.2mol电子,则转移0.2mol电子生成氧气为0.05mol,体积为0.05mol×22.4Lmol-1=1.12L,因为B中共收集到2.24L(标准状况)气体,则在阴极也生成1.12L气体,由反应式2H++2e-=H2↑得,阴极生成氢气转移0.1mol电子,则Cu2++2e-=Cu中转移0.1mol电子,所以Cu2+的物质的量为0.05mol,通电前c(CuSO4)=0.05mol÷0.2L=0.25 mol·L-1。
(5)C装置两极分别为Cu、Ag,电解质溶液为硝酸银溶液,导线连接后形成原电池,Cu作负极失电子发生氧化反应,故负极的电极反应式为:Cu-2e-=Cu2+。


科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如图1所示. 
根据判断出的元素回答问题:
(1)f在元素周期表的位置是 .
(2)d、e能形成原子个数比为1:1的化合物,该化合物的电子式为 , 0.10mol该化合物与足量水反应时转移的电子数为
(3)上述元素可组成盐R:zx4f(gd4)2 , 向盛有10mL1mol/L R溶液的烧杯中滴加1mol/LNaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如图2:
①在m段发生反应的离子方程式为 .
②若在10mLlmol/L R溶液中改加20mLl.2mol/L Ba(OH)2溶液,充分反应后,溶液中产生的沉淀的物质的量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 蒸馏法是海水淡化的常用方法B. 水垢中的CaSO4可用醋酸除去
C. 糖类、油脂、蛋白质都可以水解D. 沾附水滴的铁质餐具生锈主要是化学腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,a、b、c、d均为石墨电极,通电进行电解,下列说法正确的是( )

A. 电路中电子流向:负极→d→c→b→a→正极
B. a、c两极产生气体的物质的量相等
C. SO42-向b电极运动,Cl-向c电极运动
D. 通电后乙烧杯滴入酚酞溶液d极会变红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见铅蓄电池是二次电池,其电极材料分别为Pb和PbO2,电解液为稀H2SO4溶液,工作时的总反应式为Pb +PbO2 + 2H2SO4 ![]() 2PbSO4 +2H2O。请依据上述情况判断:
2PbSO4 +2H2O。请依据上述情况判断:
(1)铅蓄电池的负极材料是________________。
(2)请依据两极材料和总反应,写出放电时正极反应是______________。
(3)请依据总反应式和正极反应式,写出放电时负极反应是________________________。(4)放电时,电解质溶液中阴离子移向______极;电流方向从______极流向______极。
(5)放电时,电解质溶液的酸性_________(填“增强”、“减弱”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,摩托罗拉公司开发了一种以液态甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月.下图是一个电化学过程的示意图.

已知甲池的总反应式为:2CH3OH+3O2+4KOH![]() 2K2CO3+6H2O
2K2CO3+6H2O
请填空:
(1)充电时:①原电池的负极与电源________极相连 ②阳极的电极反应为_________________.
(2)在此过程中若完全反应,乙池中B极的质量增加648g,则甲池中理论上消耗O2_____L(标准状况下).
(3)若在常温常压下,1gCH3OH燃烧生成CO2和液态H2O时放热22.68kJ,表示该反应的热化学方程式为______________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】被称为“脑黄金”的DHA,是从深海鱼油中提取出的不饱和程度很高的脂肪酸,它的分子中有6个碳碳双键,称为二十二碳六烯酸,则其甘油酯分子的结构简式为( )
A. (C21H43COO)3C3H5 B. (C21H31COO)3C3H5
C. (C22H33COO)3C3H5 D. (C22H39COO)3C3H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是一个巨大的化学资源宝库。 海水综合利用的部分流程如下:

已知:Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。
(1)电解饱和 NaCl 溶液的化学方程式为_____________________________________。粗盐中常含 Ca2+、Mg2+、SO42-等杂质离子,可依次加入NaOH、___________、___________、盐酸试剂来进行提纯。
(2)下列方法不可用于海水淡化的是________(填字母代号)。
A. 蒸馏法 B. 萃取法 C. 离子交换法 D. 电渗析法
(3)工业上用电解法制Mg 时,通常在MgCl2中加入适量 CaCl2,其原因是:①___________; ②增加电解质的密度,便于分离出熔融的镁。
(4) 利用右图所示装置从母液中提取溴,在 B 瓶中得到较浓的溴水。实验方案为:关闭b、d,打开a、c,由a 向A中缓慢通入________至反应完全;关闭a、c,打开b、d、e,由b向A中鼓入足量__________, 同时由 e 向 B 中通入足量_________;关闭b、e,打开a,再由a 向B中缓缓鼓入足量___________ (实验中须使用的试剂有:SO2、Cl2、热空气) 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在1×105 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气,放出484 kJ热量,下列热化学方程式正确的是( )
A. H2O(g)===H2(g)+![]() O2(g) ΔH=+242 kJ·mol-1
O2(g) ΔH=+242 kJ·mol-1
B. 2H2(g)+O2(g)===2H2O(l) ΔH=-484 kJ·mol-1
C. H2(g)+![]() O2(g)===H2O(g) ΔH=+242 kJ·mol-1
O2(g)===H2O(g) ΔH=+242 kJ·mol-1
D. 2H2(g)+O2(g)===2H2O(g) ΔH=+484 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com