
【题目】下列药品可用带玻璃塞的试剂瓶存放的是
A.盐酸 B.氢氟酸 C.NaOH溶液 D.Na2SiO3溶液
科目:高中化学 来源: 题型:
【题目】某溶液中仅含有Na+、Mg2+、SO42-、Cl-四种离子(不考虑水电离出的H+和OH-),其物质的量之比为n(Na+): n(Mg2+): n(Cl-)=3:5:5。若Na+的物质的量为3mol,则SO42-的物质的量为
A. 2mol B. 3mol C. 4mol D. 8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在一定条件下反应,可以制得较纯净一氯乙烷的是
A. 乙烷与氯气取代B. 乙烯与氯化氢加成
C. 乙烯与氯气加成D. 乙烯与氢气加成,再用氯气取代
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中含有丰富的Na+、Mg2+、Cl-、Br-等化学资源。将海水淡化与浓缩海水结合是综合利用海水资源的途径之一。以浓缩海水为原料,通过一系列工艺流程可以提取Mg、Br2等产品。
(1)如图是采用膜分离技术的海水淡化示意图。

淡化膜可以让水分子通过,而海水中其他分子和离子均不能通过。加压后,左侧淡水中增加的是__________(填字母)。
a.溶质质量 b.溶剂质量 c.溶质的质量分数
(2)从海水中提取镁的主要步骤如下:

①操作a的名称是_______________。
②写出B冶炼金属镁的化学方程式_______________________________。
(3)空气吹出法是用于工业规模海水提溴的常用方法,其中一种工艺是以预先经过酸化的浓缩海水为原料,通过以下步骤提取溴:
步骤一:用氯气置换溴离子使之成为单质溴;
步骤二:通入空气和水蒸气,将溴吹入吸收塔,使溴蒸气和吸收剂SO2发生作用转化成氢溴酸;
步骤三:用氯气将氢溴酸氧化得到产品溴。
①步骤一和步骤二的目的是___________________________________。
②步骤二中发生反应的化学方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸镁晶体是一种新型吸波隐形材料中的增强剂。
I.合成该物质的步骤如下:
步骤 1:配制一定浓度的![]() 溶液和
溶液和![]() 溶液。
溶液。
步骤 2:量取一定量的![]() 溶液于容器中,搅拌并逐滴加入
溶液于容器中,搅拌并逐滴加入![]() 溶液,温度控制在 50℃, 用氨水调节溶液 pH 到 9.5。
溶液,温度控制在 50℃, 用氨水调节溶液 pH 到 9.5。
步骤 3:放置1 h后,过滤、洗涤、干燥,得碳酸镁晶体产品[![]() (n=1~5)]。
(n=1~5)]。
回答下列问题:
(1)配制 250 mL 0.5mol/LMgSO4溶液,所需的玻璃仪器除烧杯、玻璃棒和量筒外还有_________。
(2)步骤 2 中反应的离子方程式为_____________________。
(3)检验碳酸镁晶体是否洗干净的方法是_______________________。
Ⅱ.测定产品![]() 中的 n 值(仪器和药品如图所示):
中的 n 值(仪器和药品如图所示):

(4)上述装置的连接顺序为______(按气流方向,用接口字母表示),其中 C 的作用是_________。
(5)加热前先通入![]() 排尽装置中的空气,称取装置 C、D 的初始质量后,边加热边通入
排尽装置中的空气,称取装置 C、D 的初始质量后,边加热边通入![]() 的作用是________。
的作用是________。
(6)若装置 B 中无残留物,要准确测定 n 值,至少需要下列所给数据中的____(填选项字母),写出相应的数学表达式:n=______。
①装置 A 反应前后质量差![]() ②装置 C 反应前后质量差
②装置 C 反应前后质量差![]() ③装置 D 反应前后质量差
③装置 D 反应前后质量差![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.物质的量浓度相同的溶液中所含溶质的微粒数相同
B.常温常压下,0.1molH2气体约含6.02×1022个H2分子
C.1molL﹣1醋酸溶液100mL中H+的个数约为0.1NA
D.标准状况下,1molH2O的体积约22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某探究小组用HNO3 与大理石反应过程中质量减小的方法研究影响反应速率的因素。所用HNO3浓度为1.00mol/L、2.00mol/L,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HN03 的用量为25.0mL、大理石用量为10.00g。
(1)请完成以下实验设计表,在实验目的一栏中填出对应的实验编号:
试验编号 | T/K | 大理石规格 | HNO3浓度mol/L | 实验目的 |
① | 298 | 粗颗粒 | 2.00 | 实验①和②探究HNO3 浓度对该反应速率的影响; (II)实验①和____探究温度对该反应速率的影响; (III)实验①和____探究大理石规格(粗、细)对该反应速率的影响。 |
② | 298 | 粗颗粒 | 1.00 | |
③ | 308 | 粗颗粒 | 2.00 | |
④ | 298 | 细颗粒 | 2.00 |
(2)实验①中CO2质量随时间变化的关系见图:
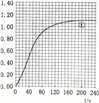
依据反应方程式CaCO3+2HNO3=Ca(NO3)2+CO2↑+H2O,计算实验①在70~90s范围内HNO3的平均反应速率_______。(忽略溶液体积变化)
(3)请在上图中,画出实验②和③中CO2质量随时间变化关系的预期结果示意图,并标出线的序号_______。
(4)工业上己实现CO2和H2反应生成甲醇的转化。己知:在一恒温、恒容密闭容器中充入1mol CO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)。测得CO2和CH3OH (g)的浓度随时间变化如下图所示。请回答:

①达到平衡时H2的转化率为_______。在前10min内,用CO2表示的反应速率:V(CO2)=______mol/(L·min)
②能判断该反应达到化学平衡状态的依据是_______。
a.容器压强不变 b.混合气体中c(CO2)不变
c. v(CH3OH)=v(H2O) d. c(CH3OH)=c(H2O)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com