
| aL |
| 22.4L/mol |
| ||
| aL |
| 22.4L/mol |
| a |
| 22.4 |
| a |
| 22.4 |
| 2a |
| 3��22.4 |
| a |
| 33.6 |
| a |
| 33.6 |
| 27a |
| 33.6 |
| ||
| 10.7g |
| ||
|
| 0.1mol��3��22.4L |
| 2mol |
| ||
| 0.5mol |
| 1.0mol/L |


 ��У��������ĩ��̾�ϵ�д�
��У��������ĩ��̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������Na��NaOH���ն�����Na2CO3 |
| B��ŨH2SO4��Ũ�����Ũ�ȶ����С |
| C��ˮ�����Ͳ��������ȶ���������� |
| D����ʯ�Һͼ�ʯ�Ҷ���������е�CO2��Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Ŀǰ���ֵ�����Ԫ��ռ�������ڱ���ȫ��λ�ã������������µ�Ԫ�ر����� |
| B��Ԫ�ص���������ԭ�����������Ӷ��������Ա仯 |
| C��������ѧ�ҵ�����ΪԪ�����ڱ��Ľ��������˾��� |
| D������������Ϊ8��������ϡ������Ԫ�ص�ԭ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
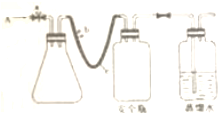 ʵ���������з����ⶨijˮ����O2�ĺ���
ʵ���������з����ⶨijˮ����O2�ĺ���2- 3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A����ԭ�ӵĽṹʾ��ͼ�� | ||
B��H2O���ӵı���ģ�ͣ� | ||
C����Ϊ���ԭ�������ⶨ����̼���أ�
| ||
D���õ���ʽ��ʾ�Ȼ�����ӵ��γɹ��̣� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��V����B2���T2V����AB�� |
| B����λʱ��������2molAB��ͬʱ����1mol��B2 |
| C�������ڵ���ѹǿ����ʱ����仯 |
| D�������ܶȲ�����ʱ��仯���仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �ش���������л�ʵ������⣮
�ش���������л�ʵ������⣮�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com