
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
分析 强酸、强碱在水溶液中完全电离,加水稀释过程中导致酸或碱浓度降低,如果加水稀释到10n倍,稀释后溶液pH增大n或减小n,稀释后溶液的pH仍然小于或大于7;
弱酸、弱碱在水溶液中部分电离,加水稀释过程中弱酸或弱碱仍然电离,导致稀释后溶液pH增大或减小n,据此分析解答.
解答 解:①强酸在水溶液中完全电离,如果强酸pH=a,加水稀释到10n倍,则pH=a+n<7,若a+n>7,则让pH=7,故错误;
②强碱在水溶液中完全电离,如果强碱pH=b,加水稀释到10n倍,则pH=b-n>7,若a+n,<7,则让pH=7,故错误;
③弱酸在水溶液中存在电离平衡,加水稀释促进弱酸电离,如果弱酸pH=a,加水稀释到10n倍,则pH<a+n(a+n<7),故正确;
④弱碱在水溶液中部分电离,加水稀释促进弱碱电离,如果弱碱pH=b,加水稀释到10n倍,则pH>b-n(b-n>7),故正确;
故选C.
点评 本题考查pH有关计算,明确强弱电解质电离特点是解本题关键,注意:稀释溶液接近中性时要考虑水的电离,为易错点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
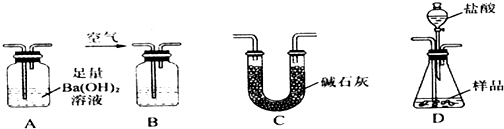
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯和乙烯都能使溴水褪色,且反应原理相同 | |
| B. | 乙炔和苯均为不饱和烃,都只能发生加成反应 | |
| C. | 分子式为C10H14 苯环上只有一个取代基的芳香烃,其可能的结构有3种 | |
| D. | 乙烯和氯乙烯都可以通过聚合反应得到高分子材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强碱性溶液:Mg2+、NH4+、Cl-、NO3- | |
| B. | 使甲基橙变红的溶液:Na+、Fe3+、Cl-、S2O32- | |
| C. | 无色溶液中:K+、Al3+、HCO3-、Cr2O72- | |
| D. | 常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、Na+、AlO2-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
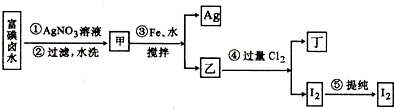
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
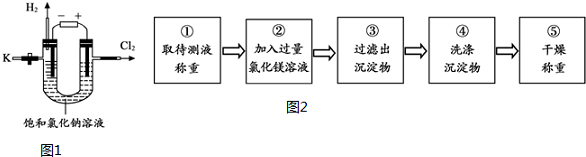
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com