
分析 C4H8O2属于酯类的同分异构体,为饱和一元酯;C4H8O2属于羧酸时,可以根据羧基位置异构可以得到丁酸的同分异构体;C4H8O2属于羟基醛时,可以根据官能团的位置异构得到其同分异构体;根据六元环结合有机物的分子式来确定.
解答 解:C4H8O2属于酯类的同分异构体,为饱和一元酯,为甲酸与丙醇形成的酯,甲酸只有1种结构,丙醇可以可知1个-OH取代丙烷中的H原子,丙烷分子中有2种H原子,形成的丙醇有2种,HCOOCH2CH2CH3,HCOOCH(CH3)2;为乙酸与乙醇形成的酯,只有1种CH3COOC2H5;为丙酸与甲醇形成的酯,只有1种CH3CH2COOCH3;
C4H8O2属于羧酸时,是CH3CH2CH2COOH、CH3(CH3)CHCOOH,共两种同分异构体;
C4H8O2属于羟基醛时,可以是HOCH2CH2CH2CHO、CH3HOCHCH2CHO、CH3CH2HOCHCHO、HO(CH3)CHCH2CHO、HOCH2(CH3)CHCHO,共5种同分异构体;
C4H8O2存在分子中含有六元环的同分异构体: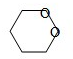 ;
;
故答案为:HCOOCH2CH2CH3、HCOOCH(CH3)2、CH3COOC2H5、CH3CH2COOCH3、CH3CH2CH2COOH、CH3(CH3)CHCOOH、HOCH2CH2CH2CHO、CH3HOCHCH2CHO、CH3CH2HOCHCHO、HO(CH3)CHCH2CHO、HOCH2(CH3)CHCHO、 .
.
点评 本题考查酯类同分异构体的判断,是高考中的常见题型,属于中等难度的试题,试题基础性强,侧重对酯类组成与结构的熟悉掌握程度,有利于培养学生的逻辑推理能力.


科目:高中化学 来源: 题型:解答题
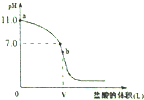 常温时,向浓度为0.1mol/L体积为V L的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而变化的滴定曲线如图所示,b点表示两种溶液恰好完全反应.
常温时,向浓度为0.1mol/L体积为V L的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而变化的滴定曲线如图所示,b点表示两种溶液恰好完全反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  除去CO的CO2 | B. |  萃取时振荡混合液 | ||
| C. | 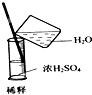 稀释浓硫酸 | D. |  向试管中滴加液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
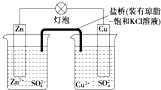
| A. | 正极反应为:Zn-2e-═Zn2+ | B. | 盐桥中的K+移向ZnSO4溶液 | ||
| C. | 在外电路中,电流从负极流向正极 | D. | 电池反应为:Zn+Cu2+═Zn2++Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
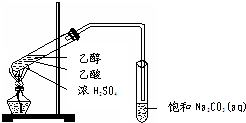 实验室用如图所示的装置制取乙酸乙酯.
实验室用如图所示的装置制取乙酸乙酯. CH3COOC2H5+H2O,乙酸乙酯的密度比水小(填“大”或“小”),有芳香味.
CH3COOC2H5+H2O,乙酸乙酯的密度比水小(填“大”或“小”),有芳香味.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
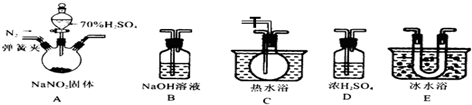
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
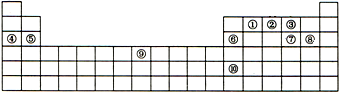 下表是元素周期表的一部分,表中每一序号分别代表一种元素.
下表是元素周期表的一部分,表中每一序号分别代表一种元素.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8.64 g | B. | 9.00 g | C. | 9.20 g | D. | 9.44 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com