
| A. |  除去CO的CO2 | B. |  萃取时振荡混合液 | ||
| C. | 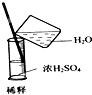 稀释浓硫酸 | D. |  向试管中滴加液体 |
分析 A.洗气装置中导气管遵循“长进短出”原则;
B.左手握住活塞部分,右手食指顶住塞子,把分液漏斗倒转过来振荡,使两种液体充分混合;
C.量筒只能量取溶液,不能作反应容器、不能配制溶液,稀释浓硫酸时将浓硫酸倒入水中;
D.向试管中滴加溶液时,胶头滴管应该悬空.
解答 解:A.洗气装置中导气管遵循“长进短出”原则,否则易导致氢氧化钠溶液被排出而达不到实验目的,故A错误;
B.左手握住活塞部分,右手食指顶住塞子,把分液漏斗倒转过来振荡,使两种液体充分混合,使溶质尽可能的被萃取,故B正确;
C.量筒只能量取溶液,不能作反应容器、不能配制溶液,如果稀释浓硫酸,应该将量筒紧贴烧杯口,把浓硫酸倒入烧杯中并不断搅拌,防止放出的热量使局部温度过高而溅出液体,故C错误;
D.向试管中滴加溶液时,胶头滴管应该悬空,否则会污染胶头滴管,故D错误;
故选B.
点评 本题考查实验方案评价,涉及实验基本操作,同时该题侧重于学生的分析能力、实验能力和评价能力的考查,注意把握操作方法,易错选项是D,很多同学往往害怕溶液会滴到试管外面而将胶头滴管伸入试管中,只有氢氧化亚铁的制备中将胶头滴管伸入试管中的液面下,为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 环保热词“PM2.5”是指大气中直径小于或等于2.5 微米(1微米=1×10-6米)的颗粒,“PM2.5”与空气形成的分散系属于胶体 | |
| B. | 食盐中加入少量碘化钾,食用后可补充人体内碘元素的不足 | |
| C. | 石油催化裂化的主要目的是提高汽油等轻质油的产量与质量,石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃 | |
| D. | 晶体硅是通信工程中制作光导纤维的主要原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
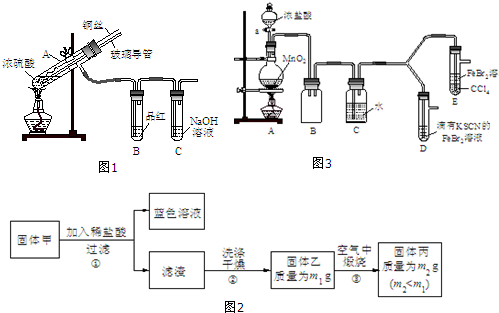
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯. | D装置中:溶液变红 E装置中:水层溶液变黄,振荡后,CCl4层无明显变化. | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: Cl2>Br2>Fe3+ |
| ⅰ.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2. ⅱ.Cl2和Br2反应生成的BrCl呈红色,沸点约5℃,与水发生水解反应. ⅲ.AgClO、AgBrO均可溶于水. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | Ⅰ | Ⅱ |
| A | SO2有漂白性 | SO2可使溴水褪色 |
| B | SiO2有导电性 | SiO2可用于制备光导纤维 |
| C | Fe3+有氧化性 | 利用30%的FeCl3溶液腐蚀铜箔制造印刷线路板 |
| D | C12有剧毒 | 大量氯气泄漏时,用烧碱溶液浸湿软布蒙面,并迅速离开现场 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们的化学性质完全不同 | B. | 它们是碳元素的三种同位素 | ||
| C. | 它们是碳元素的三种单质 | D. | 它们是碳元素的同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 将一小块钠放入乙醇中 | 产生大量气泡 | 该乙醇中含有大量的水 |
| B | 铜片加入浓硝酸中 | 产生红棕色气体 | 浓硝酸具有氧化性 |
| C | 向CuSO4溶液中通入H2S气体 | 出现黑色沉淀 | H2S的酸性比H2SO4强 |
| D | 过氧化钠作呼吸面具中的供氧剂 | 淡黄色粉末变白 | 过氧化钠是强氧化剂,能氧化二氧化碳 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com