
【题目】下列图示与对应的叙述相符合的是
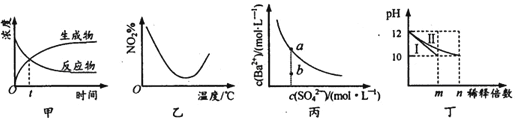
A. 图甲表示某可逆反应中物质浓度随时间的变化,反应在t时刻达到平衡状态
B. 图乙表示NO2在恒容密闭容器中发生反应:2NO2(g)![]() N2O4(g),NO2体积分数与温度的变化曲线,则该反应的正反应△H<O
N2O4(g),NO2体积分数与温度的变化曲线,则该反应的正反应△H<O
C. 图丙表示某温度时,BaSO4在水中的溶解平衡曲线,蒸发水可使溶液由b点变到a点
D. 图丁表示分别稀释l0mLpH均为12的NaOH和NH3·H2O溶液时pH的变化,曲线I表示NH3 H2O溶液,n>100
 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
【题目】在温度T1和T2时,分别将0.50 mol CH4和1.20 mol NO2充入体积为1 L的密闭容器中,发生如下反应:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
时间/min | 0 | 10 | 20 | 40 | 50 | |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | …… | 0.15 |
下列说法正确的是( )
A. T1时0~10 min NO2的平均反应速率为0.15 mol·L-1·min -1
B. T2时CH4的平衡转化率为70.0%
C. 保持其他条件不变,T1时向平衡体系中再充入0.30 mol CH4和0.80 mol H2O(g),平衡向正反应方向移动
D. 保持其他条件不变,T1时向平衡体系中再充入0.50 mol CH4和1.20 mol NO2,与原平衡相比,达新平衡时N2的浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下表为元素周期表的一部分,请回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)⑧的元素符号是________(填写元素符号)。
(2)表中金属性最强的元素是____(填元素符号),该元素在周期表中的位置是_______。
(3)写出①、③、④最高价氧化物对应的水化物两两反应的化学方程式
_________________________________
_________________________________
_________________________________
(4)请设计一个实验方案,比较⑦、⑧非金属性的强弱(用化学方程式表示):_______。
(5)③、⑦两种元素形成的化合物的电子式为_____,⑦的气态氢化物的电子式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 用Ba(OH)2溶液吸收氯气:2OH-+ 2Cl2 =2Cl-+ClO-+H2O
B. Cu 溶于稀HNO3: Cu + 2H++ NO3- = Cu2+ + NO2↑+ H2O
C. NO2溶于水:3NO2+H2O =2H++2NO3- +NO
D. 氯化镁溶液与氨水反应:Mg2+ + 2OH-= Mg(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两份体积相同,浓度未知的Na2CO3和HCl溶液,将它们互相滴加,产生的气体在相同的温度和压强下的体积比为1:3,则Na2CO3和HCl溶液的浓度之比为( )
A. 5:6 B. 2:5 C. 3:4 D. 5:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列指定溶液中微粒的浓度关系正确的是
A. 0.1mol ·L-1Na2CO3溶液中:c(OH-)=c(H+)+c(HCO3-)+ c(H2CO3)
B. 0.1mol ·L-1NH4Cl溶液中:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C. 0.2mol ·L-1H2C2O4(弱酸)与0.1mol ·L-1 NaOH溶液等体积混合的溶液中:2[c(H+)-c(OH-)]=3c(C2O42-)-c(H2C2O4)+ c(HC2O4-)
D. 0.1mol ·L-1Na2CO3溶液与同浓度等体积盐酸混合的溶液中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界水体中的碳元素主要以碳酸盐、碳酸氢盐和有机物形式存在。水体中有机物含量是水质的重要指标,常用总有机碳衡量(总有机碳=![]() )。某学生兴趣小组用如下实验方法测定采集水样的总有机碳。
)。某学生兴趣小组用如下实验方法测定采集水样的总有机碳。

步骤1:量取50 mL水样,加入足量硫酸,加热,通N2,并维持一段时间(装置如图,夹持类仪器省略)。
步骤2:再向水样中加入过量的K2Cr2O7溶液(可将有机物中的碳元素氧化成CO2),加热,充分反应,生成的CO2完全被100mL 0.206 mol·L-1的Ba(OH)2溶液吸收。
步骤3:将吸收CO2后的浊液过滤并洗涤沉淀,再将洗涤得到的滤液与原滤液合并,加水配制成500mL溶液。量取25.00mL溶液于锥形瓶中,加入几滴酚酞试剂,并滴加0.05mol·L-1的H2C2O4溶液,发生反应:Ba(OH)2+H2C2O4===BaC2O4↓+2H2O 恰好完全反应时,共消耗H2C2O4溶液20.00 mL。
(1)步骤1的目的是____。
(2)用H2C2O4溶液滴定至终点时,溶液颜色变化是____。
(3)计算水样的总有机碳(以mg·L-1表示),并写出计算过程。____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和实验现象所得到的实验结论正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 向亚硫酸钠试样中滴入盐酸酸化的Ba(C1O)2溶液 | 产生白色沉淀 | 试样已氧化变质 |
B | 向氯仿样品中加入硝酸银溶液 | 有白色沉淀产生 | 样品已变质 |
C | 向待测液中依次滴入氯水和KSCN溶液 | 溶液变为红色 | 待测液中含有Fe2+ |
D | 向NaHCO3溶液中滴加NaAlO2溶液 | 有白色沉淀和气体产生 | AlO2-与HCO3-发生了双水解反应 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成碳族元素中C与Si的非金属性强弱比较的实验研究;
乙同学设计了如图装置来验证卤族元素性质的递变规律。A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。
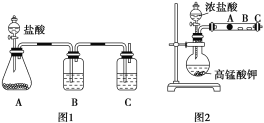
((1)甲同学设计实验的依据是强酸制弱酸,请回答下列问题
A中锥形瓶装入的是碳酸钙固体,A中发生的离子方程式为:_____,
B应放入的物质是____,其作用为____;
C中是Na2SiO3溶液该反应的离子方程式为___________。
(2)乙同学的实验原理是强氧化剂生成弱氧化剂。
如果A处的棉花由白色变成棕色,则A处的离子方程式为___,B处的现象是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com