
【题目】某研究性学习小组设计了一组实验来探究元素周期律。
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成碳族元素中C与Si的非金属性强弱比较的实验研究;
乙同学设计了如图装置来验证卤族元素性质的递变规律。A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。
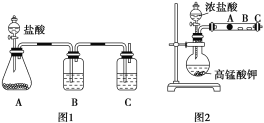
((1)甲同学设计实验的依据是强酸制弱酸,请回答下列问题
A中锥形瓶装入的是碳酸钙固体,A中发生的离子方程式为:_____,
B应放入的物质是____,其作用为____;
C中是Na2SiO3溶液该反应的离子方程式为___________。
(2)乙同学的实验原理是强氧化剂生成弱氧化剂。
如果A处的棉花由白色变成棕色,则A处的离子方程式为___,B处的现象是___。
【答案】CaCO3 + 2H+ = Ca+ + H2O + CO2↑ 饱和NaHCO3溶液 除去CO2中的HCl气体 SiO![]() +2CO2+2H2O===H2SiO3↓+2HCO
+2CO2+2H2O===H2SiO3↓+2HCO![]() (CO2过量) 2Br-+Cl2===2Cl-+Br2 淀粉碘化钾试纸变蓝
(CO2过量) 2Br-+Cl2===2Cl-+Br2 淀粉碘化钾试纸变蓝
【解析】
(1)根据信息知道:甲同学根据元素非金属性与对应最高价含氧酸之间的关系如图1装置来一次性完成C、Si三种非金属元素的非金属性强弱比较,根据强酸制弱酸来回答即可;B的作用是除去二氧化碳中氯化氢,C中二氧化碳和硅酸钠反应;
(2)根据氧化性强的单质可以将氧化性弱的单质从其盐中置换出来结合反应产物来分析。
(1)根据题干信息:甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素非金属性强弱比较的实验研究,碳酸酸性强于硅酸,最高价氧化物对应水化物酸性越强,则元素的非金属性越强,根据强酸制弱酸来设计反应;A中锥形瓶装入的是碳酸钙固体,用来制取二氧化碳,A中发生的离子方程式为:CaCO3 + 2H+ = Ca+ + H2O + CO2↑;盐酸易挥发,故B的作用是除去二氧化碳中氯化氢,故B为饱和碳酸钠溶液;C为硅酸钠溶液,二氧化碳和硅酸钠发生反应离子方程式为:SiO![]() +2CO2+2H2O==H2SiO3↓+2HCO
+2CO2+2H2O==H2SiO3↓+2HCO![]() (CO2过量);
(CO2过量);
因此,本题正确答案是:CaCO3 + 2H+ = Ca+ + H2O + CO2↑;饱和NaHCO3溶液;除去CO2中的HCl气体 ;SiO![]() +2CO2+2H2O==H2SiO3↓+2HCO
+2CO2+2H2O==H2SiO3↓+2HCO![]() (CO2过量);
(CO2过量);
(2)根据题干信息:乙同学设计了如图2装置来验证卤族元素性质的递变规律,所以乙同学的实验原理是非金属性强的元素对应的单质可置换出非金属性弱的元素对应的单质,高锰酸钾和浓盐酸反应会产生氯气,氯气具有氧化性,能将溴离子,碘离子氧化为对应的单质,即A处:2Br-+Cl2===2Cl-+Br2,棉花变成橙黄色,B处:2I-+Cl2===2Cl-+I2,试纸变蓝色;
因此,本题正确答案是:2Br-+Cl2===2Cl-+Br2;淀粉碘化钾试纸变蓝。


科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符合的是
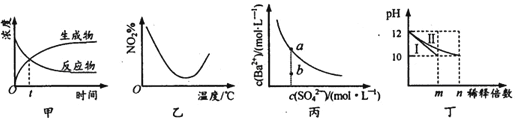
A. 图甲表示某可逆反应中物质浓度随时间的变化,反应在t时刻达到平衡状态
B. 图乙表示NO2在恒容密闭容器中发生反应:2NO2(g)![]() N2O4(g),NO2体积分数与温度的变化曲线,则该反应的正反应△H<O
N2O4(g),NO2体积分数与温度的变化曲线,则该反应的正反应△H<O
C. 图丙表示某温度时,BaSO4在水中的溶解平衡曲线,蒸发水可使溶液由b点变到a点
D. 图丁表示分别稀释l0mLpH均为12的NaOH和NH3·H2O溶液时pH的变化,曲线I表示NH3 H2O溶液,n>100
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,该燃料电池的电池反应式为:2CH3OH(l) + 3O2(g) → 2CO2 (g) + 4H2O(l),其工作原理示意图如图,下列说法正确的是( )
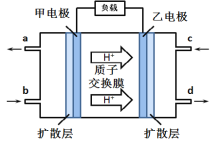
A. 甲为电池的负极,发生还原反应
B. 负极的电极反应式为:CH3OH +H2O-6e-=CO2+6H+
C. b口通入的气体为O2
D. 用该电池进行电解水,当电路中转移0.2NA个电子时,生成2.24L氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可利用硫酸厂废渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O),聚铁的化学式可表示为[Fe2(OH)n(SO4)3-0.5n]m,主要工艺流程下:
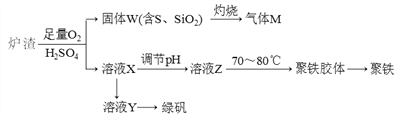
下列说法不正确的是
A. 炉渣中FeS与稀硫酸和氧气反应的离子方程式为:4FeS+3O2+12H+===4Fe3++4S↓+6H2O
B. 气体M的成分是SO2,通入H2O2溶液得到硫酸,可循环使用
C. 向溶液X中加入过量铁粉,充分反应后过滤得到溶液Y,再经蒸干即得绿矾
D. 溶液Z的pH影响聚铁中铁的质量分数,若其pH偏小,将导致聚铁中铁的质量分数偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定微粒的数目相等的是
A. 等质量的乙烯和丙烯中含有的共用电子对数
B. 等物质的量的水与重水含有的中子数
C. 同温、同压、同体积的CO和NO含有的质子数
D. 等物质的量的铁和铝分别与足量盐酸完全反应时转移的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
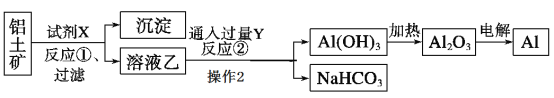
(1)试剂X应选择________(选填“氢氧化钠溶液”、“盐酸”),反应①过滤后所得沉淀为__ ;反应①的离子方程式_____;
(2)反应②中Y是_____(写化学式);
(3)写出由Al(OH)3加热为Al2O3的反应方程式_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、生活密切相关,下列说法不正确的是
A. 天然气是高效清洁燃料和重要的化工原料
B. 人造放射性同位素,在工农业、医疗等方面有重要用途
C. 氢键在生命现象中也起着重要作用
D. 芳香族化合物都有芳香性气味
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)甲氧普胺(Metoclopramide)是一种消化系统促动力药.它的工业合成路线如下[已知氨基(-NH2)易被氧化剂氧化]:
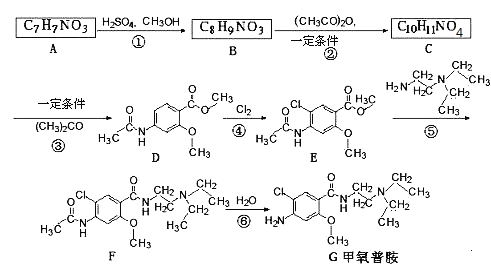
请回答下列问题:
(1)下列说法中不正确的是 (_______)
A、化合物A能形成内盐 B、1molB最多能与2molNaOH反应
C、D的分子式为C11H13NO3 D、甲氧普胺属于芳香族化合物
(2)化合物C的结构简式:_______________________________________
(3)写出D→E的化学方程式:______________________________________________________
(4)写出符合下列要求的化合物A(C7H7NO3)的可能的同分异构体 _________________________
①属于芳香族化合物,能发生银镜反应 ②能发生水解 ③苯环上的一氯取代物只有两种
(5)写出以甲苯为原料合成对氨基苯甲酸:![]() ,模仿以下流程图设计合成路线,标明每一步的反应物及反应条件_________。(有机物写结构简式,其它无机试剂自选)
,模仿以下流程图设计合成路线,标明每一步的反应物及反应条件_________。(有机物写结构简式,其它无机试剂自选)
已知:Ⅰ、当一取代苯进行取代反应时,使新取代基进入它的邻、对位的取代基:-CH3、-NH2;使新取代基进入它的间位的取代基:-COOH、-NO2;
Ⅱ、-NH2易被氧化;-NO2可被Fe和HCl还原成-NH2。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com