
【题目】甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,该燃料电池的电池反应式为:2CH3OH(l) + 3O2(g) → 2CO2 (g) + 4H2O(l),其工作原理示意图如图,下列说法正确的是( )
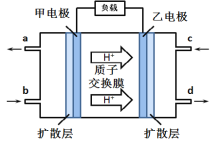
A. 甲为电池的负极,发生还原反应
B. 负极的电极反应式为:CH3OH +H2O-6e-=CO2+6H+
C. b口通入的气体为O2
D. 用该电池进行电解水,当电路中转移0.2NA个电子时,生成2.24L氢气
科目:高中化学 来源: 题型:
【题目】如下表为元素周期表的一部分,请回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)⑧的元素符号是________(填写元素符号)。
(2)表中金属性最强的元素是____(填元素符号),该元素在周期表中的位置是_______。
(3)写出①、③、④最高价氧化物对应的水化物两两反应的化学方程式
_________________________________
_________________________________
_________________________________
(4)请设计一个实验方案,比较⑦、⑧非金属性的强弱(用化学方程式表示):_______。
(5)③、⑦两种元素形成的化合物的电子式为_____,⑦的气态氢化物的电子式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界水体中的碳元素主要以碳酸盐、碳酸氢盐和有机物形式存在。水体中有机物含量是水质的重要指标,常用总有机碳衡量(总有机碳=![]() )。某学生兴趣小组用如下实验方法测定采集水样的总有机碳。
)。某学生兴趣小组用如下实验方法测定采集水样的总有机碳。

步骤1:量取50 mL水样,加入足量硫酸,加热,通N2,并维持一段时间(装置如图,夹持类仪器省略)。
步骤2:再向水样中加入过量的K2Cr2O7溶液(可将有机物中的碳元素氧化成CO2),加热,充分反应,生成的CO2完全被100mL 0.206 mol·L-1的Ba(OH)2溶液吸收。
步骤3:将吸收CO2后的浊液过滤并洗涤沉淀,再将洗涤得到的滤液与原滤液合并,加水配制成500mL溶液。量取25.00mL溶液于锥形瓶中,加入几滴酚酞试剂,并滴加0.05mol·L-1的H2C2O4溶液,发生反应:Ba(OH)2+H2C2O4===BaC2O4↓+2H2O 恰好完全反应时,共消耗H2C2O4溶液20.00 mL。
(1)步骤1的目的是____。
(2)用H2C2O4溶液滴定至终点时,溶液颜色变化是____。
(3)计算水样的总有机碳(以mg·L-1表示),并写出计算过程。____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和实验现象所得到的实验结论正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 向亚硫酸钠试样中滴入盐酸酸化的Ba(C1O)2溶液 | 产生白色沉淀 | 试样已氧化变质 |
B | 向氯仿样品中加入硝酸银溶液 | 有白色沉淀产生 | 样品已变质 |
C | 向待测液中依次滴入氯水和KSCN溶液 | 溶液变为红色 | 待测液中含有Fe2+ |
D | 向NaHCO3溶液中滴加NaAlO2溶液 | 有白色沉淀和气体产生 | AlO2-与HCO3-发生了双水解反应 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸钡粉体是电子陶瓷元器件的重要基础原料,其制备工艺流程如下图所示:
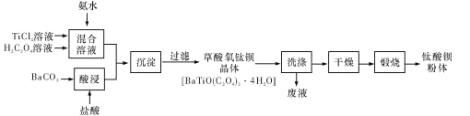
(1)镁的碳化物常见的有MgC2和Mg2C3两种,它们均极易与水发生反应。写出MgC2发生水解反应的化学方程式:_____;Mg2C3的电子式为_____。
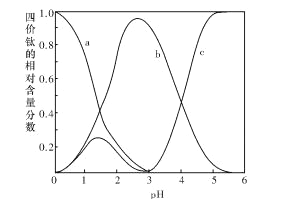
(2)“混合溶液”环节,钛元素在不同pH下主要以种形式存在,如上图所示。实际制备工艺中,先用氨水调节混合溶液的pH于2.5~3之间,再进行“沉淀”,则上图中曲线a对应钛的形式为______填化学符号);写出“沉淀”时的离子方程式:_____。
(3)草酸氧钛钡晶体经蒸馏水数次洗涤后,证明它已被洗涤干净的实验方案为_____。
(4)工业上TiCl4和BaCO3通常用如下方法制备:
①先将金红石(TiO2)与过量焦炭混合,再通入Cl2)并加热到900℃制取TiCl4。请写出该法制备TiCl4的化学方程式:_____。
②BaCO3是将重晶石(主要成分为BaSO4)浸泡在Na2C03溶液中足够长时间来制备。请问Na2CO3溶液的浓度至少要大于_____mol/L才能开始转化。(已知常温下:![]()
![]() ,略CO32-的水解)。
,略CO32-的水解)。
查看答案和解析>>
科目:高中化学 来源: 题型:
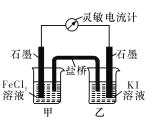
【题目】FeCl3 为中学化学中经常使用的物质,长郡化学实验小组为探究 FeCl3 的性质,进行了如下实验。
(1)学习小组 A 为探究 FeCl3与 KI 溶液的反应,特设计如右图所示的原电池实 验装置。在实验过程中,学习小组 A 发现,灵敏电流计的指针先偏转,最后 示数为零。若此时向甲中加入适量 FeCl2 固体,灵敏电流计的指针又发生偏转 此时________(填“甲”或“乙”)中石墨电极为负极,对应的电极反应方程式为_________
(2)学习小组 B 把 FeCl3 溶液分别加入Na2CO3 溶液和Na2SO3溶液中,发现有如下实验现象:
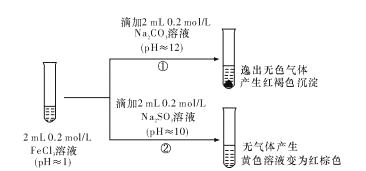
对于②中的实验现象,学习小组 B 的同学们有诸多猜测,继续进行实验: I.小明取②中的红棕色溶液少许,滴入盐酸酸化的 BaCl2溶液,产生白色沉淀。小明得出结论:FeCl3 与 Na2SO3 发生了氧化还原反应,离子方程式是_____。
Ⅱ,小红认为小明的实验不严谨,重新设计实验方案并进行实验,证实了小明的结论是正确的。其实验方 案是______________________________。
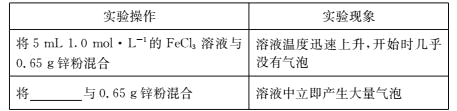
(3)学习小组 C 进一步探究 FeCl3 溶液与足量锌粉的反应。实验操作及实验现象如下表所示:

已知:Zn 的化学性质与 Al 相似,能发生反应![]()
①结合实验现象和平衡移动原理解释出现红褐色沉淀的原因:______
②分离出黑色固体,经下列实验证实了其中含有的主要物质。
i.黑色固体可以被磁铁吸引
ii.向黑色固体中加入足量的 NaOH 溶液,产生气泡;
iii.将 ii 中剩余固体用蒸馏水洗涤后,加入稀盐酸,产生大量气泡; iv.向 iii 反应后的溶液中滴加 KSCN 溶液,无变化。 a.黑色固体中一定含有的物质是_____。
b.学习小组 C 认为上述实验无法确定黑色固体中是否含有 Fe3O4,理由是__________________
(4)为进一步探究 1.0 mol/L FeCl3 溶液中 Fe3+和 H+氧化性的相对强弱,学习小组 C 补充实验并观察到反应开始时的实验现象如下表所示:
学习小组 C 得出结论:在 1.0 mol/L FeCl3 溶液中,Fe3+的氧化性比 H+强。则表格中横杠处应填____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成碳族元素中C与Si的非金属性强弱比较的实验研究;
乙同学设计了如图装置来验证卤族元素性质的递变规律。A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。
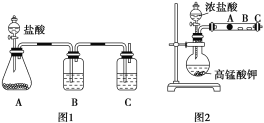
((1)甲同学设计实验的依据是强酸制弱酸,请回答下列问题
A中锥形瓶装入的是碳酸钙固体,A中发生的离子方程式为:_____,
B应放入的物质是____,其作用为____;
C中是Na2SiO3溶液该反应的离子方程式为___________。
(2)乙同学的实验原理是强氧化剂生成弱氧化剂。
如果A处的棉花由白色变成棕色,则A处的离子方程式为___,B处的现象是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 物质发生化学反应时不一定都伴随着能量变化
B. 伴有能量变化的变化都是化学变化
C. 在一个确定的化学反应中,反应物的总能量与生成物的总能量一定不同
D. 在一个确定的化学反应中,反应物的总能量总是高于生成物的总能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com