
| A. | NH3属于弱电解质 | |
| B. | 可用湿润的红色石蕊试纸检验氨气 | |
| C. | 用盐酸滴定氨水,当溶液呈中性时,c(NH4+)=c(Cl-) | |
| D. | 常温时,0.1mol•L-1NH4Cl溶液加水稀释,$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}$的值不变 |
分析 A.水溶液中或熔融状态下导电的化合物为电解质,水溶液中或熔融状态下都不导电的化合物为非电解质;
B.氨气是碱性气体,遇到湿润的红色石蕊试纸变蓝色;
C.溶液中存在电荷守恒分析;
D.平衡常数只随温度变化,不随浓度改变.
解答 解:A.NH3不能电离属于非电解质,故A错误;
B.氨气是碱性气体,遇到湿润的红色石蕊试纸变蓝色,可用湿润的红色石蕊试纸检验氨气,故B正确;
C.用盐酸滴定氨水,当溶液呈中性时,溶液中c(H+)=c(OH-),溶液中存在电荷守恒c(H+)+c(NH4+)=c(Cl-)+c(OH-),则c(NH4+)=c(Cl-),故C正确;
D.常温时,0.1mol•L-1NH4Cl溶液加水稀释,$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)c({H}^{+})}$=$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)c({H}^{+})}$×$\frac{c(O{H}^{-})}{c(O{H}^{-})}$=$\frac{Kb}{Kw}$,温度不变,比值不变,故D正确;
故选A.
点评 本题考查了物质分类、检验方法、电解质溶液中电荷守恒、平衡常数的影响因素等,掌握基础是解题关键,题目难度不大.


 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
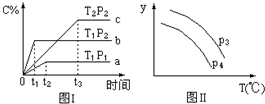
| A. | P3>P4,y轴表示B的转化率 | |
| B. | P3<P4,y轴表示B的体积分数 | |
| C. | P3<P4,y轴表示混合气体的密度 | |
| D. | P3<P4,y轴表示混合气体的平均摩尔质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
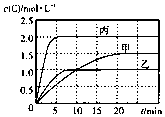 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以表和图表示
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以表和图表示| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5molA 0.5 molB | 1.5 molA 0.5 molB | 6.0 molA 2.0 molB |
| A. | 若平衡时温度不变,改变容器体积平衡不移动 | |
| B. | 由图可知:T1<T2,且该反应为吸热反应 | |
| C. | l0min内甲容器中反应的平均速率v(A)=0.025mol•(L•min)-1 | |
| D. | T1℃,起始时甲容器中充入0.5molA、1.5molB,平衡时A的转化率为25% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石蕊,由蓝变红 | B. | 酚酞,红色褪去 | C. | 甲基橙,由黄变橙 | D. | 甲基橙,由橙变黄 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与酸反应产生氢气多 | B. | 与碱反应产生氢气多 | ||
| C. | 一样多 | D. | 不知道铝粉的质量,无法比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com