
| A. | ①④⑤③②⑥ | B. | ④①③⑤②⑥ | C. | ⑤④③①②⑥ | D. | ③④⑤①②⑥ |
分析 除去粗盐中的泥沙、CaCl2、MgCl2、Na2SO4得到NaCl,加NaOH除去MgCl2,加氯化钡除去Na2SO4,加碳酸钠除去CaCl2,碳酸钠一定在氯化钡之后可除去过量的氯化钡,过滤后加盐酸、蒸发得到NaCl,以此来解答.
解答 解:除去粗盐中的泥沙、CaCl2、MgCl2、Na2SO4得到NaCl,加NaOH除去MgCl2,加氯化钡除去Na2SO4,加碳酸钠除去CaCl2,碳酸钠一定在氯化钡之后可除去过量的氯化钡,过滤后加盐酸、蒸发得到NaCl,则正确的操作顺序为⑤④③①②⑥或④⑤③①②⑥,
故选C.
点评 本题考查混合物分离提纯,为高频考点,把握元素化合物知识、除杂的原则及试剂加入顺序为解答的关键,侧重分析与实验能力的考查,注意碳酸钠一定在氯化钡之后,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | SO2既是氧化产物又是还原产物 | |
| B. | CuFeS2仅作还原剂,硫元素被氧化 | |
| C. | 每生成1mol Cu2S,有4 mol硫被氧化 | |
| D. | 每转移1.2 mol电子,有0.3 mol硫被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ①③ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、乙酸和乙酸乙酯可用饱和Na2CO3溶液鉴别 | |
| B. | 除去乙烷中少量的乙烯,可在光照条件下通入Cl2 | |
| C. | 乙烯和聚乙烯都能使溴的四氯化碳溶液褪色 | |
| D. | 蛋白质、纤维素、油脂都是高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 0.01mol•L-1酸性KMnO4溶液 | 0.1mol•L-1H2C2O4溶液 | 水 | 1mol•L-1MnSO4溶液 | 反应温度/℃ | 反应时间 |
| Ⅰ | 2mL | 2mL | 0 | 0 | 20 | 125 |
| Ⅱ | V1 mL | V2 mL | 1mL | 0 | 20 | 320 |
| Ⅲ | V3 mL | V4 mL | V5mL | 0 | 50 | 30 |
| Ⅳ | 2mL | 2mL | 0 | 2滴 | 20 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
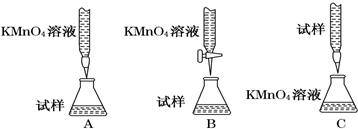
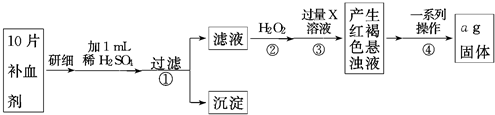
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+) | B. | Ka(HF) | C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$ | D. | $\frac{c({H}^{+})}{c(HF)}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com