
| A. | H×+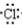 → →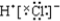 | B. | Na×+ → →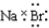 | ||
| C. |  | D. |  |
分析 A.氯化氢是共价化合物,不能用中括号表示氯化氢的电子式;
B.溴化钠是离子化合物,应用中括号表示溴化钠的电子式;
C.氟化镁为离子化合物,镁离子应放在两个氟离子之间;
D.二氧化碳是氧原子和碳原子之间通过共价键形成的共价化合物,C和O之间含有2个共用电子对.
解答 解:A.HCl为共价化合物,原子间以共用电子对成键,用电子式表示形成过程为 ,故A错误;
,故A错误;
B.溴化钠为离子化合物,钠离子与溴离子通过离子键结合,用电子式表示形成过程为 ,故B错误;
,故B错误;
C.氟离子和镁离子通过离子键形成离子化合物氟化镁,其形成过程为 ,故C错误;
,故C错误;
D.O原子和C原子通过共用电子对形成二氧化碳,所以其形成过程为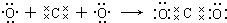 ,故D正确;
,故D正确;
故选:D.
点评 本题考查电子式以及用电子式表示形成过程,为高频考点,侧重于学生的化学用语的考查,注意相关知识的学习,把握书写方法,难度不大.


科目:高中化学 来源: 题型:解答题
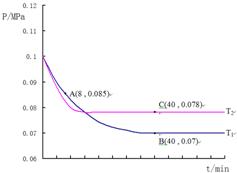 2015年,“雾霾”成为年度关键词.近年来,对“雾霾”的防护与治理成为越来越重要的环境问题和社会问题.雾霾主要由二氧化硫、氮氧化物和可吸入颗粒物这三项组成.
2015年,“雾霾”成为年度关键词.近年来,对“雾霾”的防护与治理成为越来越重要的环境问题和社会问题.雾霾主要由二氧化硫、氮氧化物和可吸入颗粒物这三项组成.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
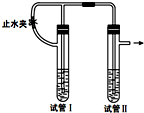 在如图装置中,用NaOH溶液、铁屑、稀硫酸等试剂制备Fe(OH)2.
在如图装置中,用NaOH溶液、铁屑、稀硫酸等试剂制备Fe(OH)2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③④ | C. | ②④⑤ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
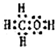 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(NaOH)=0时,c(H+)=1×10-2 mol/L | |
| B. | V(NaOH)=10mL时,c(H+)=1×10-7 mol/L | |
| C. | V(NaOH)<10mL时,可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) | |
| D. | V(NaOH)>10mL时,c(C2O42-)>c(Na+)>c(HC2O4-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com