
 2015年,“雾霾”成为年度关键词.近年来,对“雾霾”的防护与治理成为越来越重要的环境问题和社会问题.雾霾主要由二氧化硫、氮氧化物和可吸入颗粒物这三项组成.
2015年,“雾霾”成为年度关键词.近年来,对“雾霾”的防护与治理成为越来越重要的环境问题和社会问题.雾霾主要由二氧化硫、氮氧化物和可吸入颗粒物这三项组成.分析 (1)C3H6催化还原尾气中的NO气体,可以得到无毒的气体氮气和二氧化碳;
(2)②×2+③×2-①得到2NO(g)+2CO(g)?N2(g)+2CO2(g),据此计算反应的焓变;
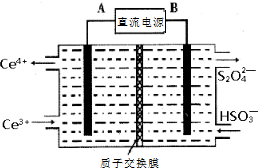
(3)电解反应中阴极上发生得电子的还原反应,根据反应原理来回答书写;
(4)①反应平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
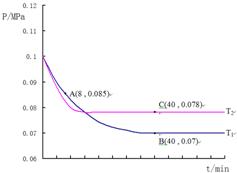
②结合化学三行计算列式,依据图中A点时,气体物质的量0.085,依据开始和A点气体物质的量之比列式计算,转化率=$\frac{变化量}{起始量}$×100%;
③图中B点,依据化学三行列式计算用平衡分压代替平衡浓度计算,分压=总压×物质的量分数计算SO2催化氧化反应在图中B点的压强平衡常数;
④先拐先平温度高,达到平衡所需时间短,温度越高反应速率越大.
解答 解:(1)C3H6催化还原尾气中的NO气体,可以得到无毒的气体氮气和二氧化碳,即2C3H6+18NO=6CO2+6H2O+9N2;故答案为:2C3H6+18NO=6CO2+6H2O+9N2;
(2))②×2+③×2-①得到2NO(g)+2CO(g)?N2(g)+2CO2(g),反应的焓变=2(+110.5kJ•mol-1)+2(-393.5kJ•mol-1)-(180.5kJ•mol-1)=-746.5kJ•mol-1,故答案为:-746.5kJ•mol-1;
(3)电解反应中阴极上发生得电子的还原反应,2HSO3-+2H++2e-=S2O42-+2H2O,故答案为:2HSO3-+2H++2e-=S2O42-+2H2O;
(4)①2SO2(g)+O2(g)?2SO3,反应的平衡常数K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})c({O}_{2})}$,
故答案为:$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})c({O}_{2})}$;
②依据化学三行列式计算,设氧气消耗物质的量为x,
2SO2(g)+O2(g)?2SO3
起始量(mol) 2a a 0
变化量(mol) 2x x 2x
平衡量(mol)2a-2x a-x 2x
图中A点时,气体物质的量0.085,则$\frac{2a-2x+a-x+2x}{2a+a}$=$\frac{0.085}{0.1}$,
x=0.45a
SO2的转化率=$\frac{0.45a×2}{2a}$×100%=45%,
故答案为:45%;
③图中B点,依据化学三行列式计算,设氧气消耗物质的量为y,
2SO2(g)+O2(g)?2SO3
起始量(mol) 2a a 0
变化量(mol) 2y y 2y
平衡量(mol)2a-2y a-y 2y
B点气体物质的量为 0.007,则$\frac{2a-2x+a-x+2x}{2a+a}$=$\frac{0.07}{0.1}$,y=0.9a,
平衡常数K=$\frac{(0.007×\frac{1.8}{0.2a+0.1a+1.8a})^{2}}{(0.007×\frac{0.2a}{0.2a+0.1a+1.8a})^{2}×(0.007×\frac{0.1a}{0.2a+0.1a+1.8a})^{\;}}$=24300(MPa)-1,
故答案为:24300(MPa)-1;
④图象分析可知,先拐先平温度高则T1<T2,C点是平衡状态,A点反应未达到平衡状态,其中C点的正反应速率vC(正)与A点的逆反应速率vA(逆)的大小关系为vC(正)>vA(逆)
故答案为:<,>.
点评 本题考查了化学平衡、化学反应速率影响因素的分析应用,图象变化和数值的计算是解题关键,题目难度中等.


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 用蘸有浓氨水的棉棒检验输送氯气的管道是否漏气 | |
| B. | 用合成聚碳酸酯可降解塑料,实现“碳”的循环利用 | |
| C. | 大力实施矿物燃料脱硫脱硝技术,能减少二氧化硫、氮氧化物的排放 | |
| D. | 向工业生产的反应中加入合适的催化剂,能改变反应的焓变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 喷水冷却燃烧物,冷却灭火 | B. | 沙土覆盖燃烧物,窒息灭火 | ||
| C. | 移开易燃易爆物,隔离灭火 | D. | 喷入化学灭火剂,抑制灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在酸性条件下,CH3CO18OC2H5水解的产物是CH3CO18OH和C2H5OH | |
| B. | 用甘氨酸(H2NCH2COOH)和丙氨酸(CH3CHNH2COOH)混合缩合,最多可形成3种二肽 | |
| C. | 苯甲醛中混有苯甲酸,加入生石灰,再加热蒸馏 | |
| D. | 将电石与饱和食盐水反应生成的气体通入溴的四氯化碳溶液中,若溶液褪色,证明有乙炔生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫、氮氧化物是形成酸雨、雾霾等环境污染的罪魁祸首,采用合适的措施消除其污染是保护环境的重要举措.
硫、氮氧化物是形成酸雨、雾霾等环境污染的罪魁祸首,采用合适的措施消除其污染是保护环境的重要举措.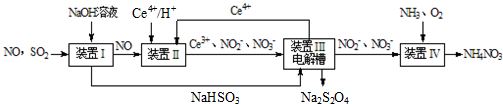
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L HF中含HF分子数目为NA | |
| B. | 60 g石英晶体中含有的Si-O键数目为2 NA | |
| C. | 标准状况下,11.2 L Cl2通人足量的石灰乳中制备漂白粉,转移的电子数为0.5 NA | |
| D. | l L 0.1 mol/L的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式符合XY2型的化合物可能由同一主族元素构成 | |
| B. | 只有在原子中,质子数才与核外电子数相等 | |
| C. | 目前使用的元素周期表中,最长的周期含有36种元素 | |
| D. | 所有的非金属元素都位于元素周期表的右半区 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com