
| A. | 用蘸有浓氨水的棉棒检验输送氯气的管道是否漏气 | |
| B. | 用合成聚碳酸酯可降解塑料,实现“碳”的循环利用 | |
| C. | 大力实施矿物燃料脱硫脱硝技术,能减少二氧化硫、氮氧化物的排放 | |
| D. | 向工业生产的反应中加入合适的催化剂,能改变反应的焓变 |
分析 A、3Cl2+8NH3═N2+6NH4Cl,该反应中产生白烟;
B、利用CO2合成聚碳酸酯类可降解塑料,减少二氧化碳的排放;
C、矿物燃料脱硫脱硝技术,能减少二氧化硫、氮氧化物的排放;
D、催化剂改变速率,不改变平衡,不会引起化学反应的焓变的变化.
解答 解:A、3Cl2+8NH3═N2+6NH4Cl,利用该反应中产生白烟现象来检验氯气管道是否漏气,故A正确;
B、利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用应用,减少二氧化碳的排放,符合题意,故B正确;
C、SO2、NOx是污染性气体,大力实施矿物燃料的脱硫脱硝技术,可以减少SO2、NOx的排放,故C正确;
D、反应焓变只和反应物生成物有关,和反应过程无关,催化剂改变速率,不改变平衡,不会引起化学反应的焓变的变化,故D错误.
故选D.
点评 本题考查了化学与生活、社会密切相关知识,主要考查物质的性质以及应用,掌握常识、理解原因是关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 36g镁在足量的氮气中完全燃烧共转移的电子数为3NA | |
| B. | 1mol铁与足量的盐酸反应转移电子数为2 NA | |
| C. | 标准状况下,44.8 L NO与22.4 LO2混合后气体中分子总数为3NA | |
| D. | 1 molNa2O和Na2O2混合物中含有的阴、阳离子总数是3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅与苛性钠反应:SiO2+2OH-═SiO32-+H2O | |
| B. | 在NaCl溶液中滴入AgNO3试液:Ag++Cl-═AgCl↓ | |
| C. | Cl2溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 用NaOH溶液吸收Cl2:Cl2+2OH-═Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
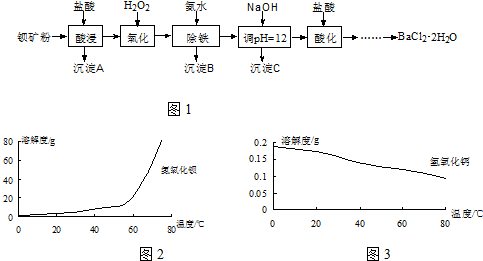
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙酰苯胺是常用的医药中间体,可由苯胺与乙酸制备.反应的化学方程式如下:
乙酰苯胺是常用的医药中间体,可由苯胺与乙酸制备.反应的化学方程式如下: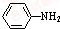 (苯胺)+CH3COOH?
(苯胺)+CH3COOH? (乙酸苯胺)+H2O
(乙酸苯胺)+H2O| 化合物 | 密度(g.cm-3) | 溶解性 | 熔点(℃) | 沸点(℃) |
| 乙酸 | 1.05 | 易溶于水、乙醇 | 17 | 118 |
| 苯胺 | 1.02 | 微溶于水,易溶于乙醇 | -6 | 184 |
| 乙酰苯胺 | - | 微溶于冷水,可溶于热水,易溶于乙醇 | 114 | 304 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
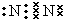 ,在这些元素中,化学性质最不活泼的是:Ar
,在这些元素中,化学性质最不活泼的是:Ar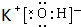 .
.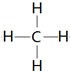 .
. ,该化合物属于离子 (填“共价”或“离子”)化合物.
,该化合物属于离子 (填“共价”或“离子”)化合物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2015年,“雾霾”成为年度关键词.近年来,对“雾霾”的防护与治理成为越来越重要的环境问题和社会问题.雾霾主要由二氧化硫、氮氧化物和可吸入颗粒物这三项组成.
2015年,“雾霾”成为年度关键词.近年来,对“雾霾”的防护与治理成为越来越重要的环境问题和社会问题.雾霾主要由二氧化硫、氮氧化物和可吸入颗粒物这三项组成.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com