
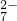 的废水的原理如下:向含Cr2O
的废水的原理如下:向含Cr2O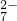 的酸性废水中加入FeSO4?7H2O,将Cr2O
的酸性废水中加入FeSO4?7H2O,将Cr2O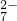 还原为Cr3+,调节溶液的pH,使铁、铬元素转化为组成相当于FeⅡ[FeⅢx?CrⅢ2-x]O4(铁氧磁体、罗马数字表示元素的价态)的沉淀.处理含1mol Cr2O
还原为Cr3+,调节溶液的pH,使铁、铬元素转化为组成相当于FeⅡ[FeⅢx?CrⅢ2-x]O4(铁氧磁体、罗马数字表示元素的价态)的沉淀.处理含1mol Cr2O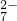 的废水至少需要加入a mol FeSO4?7H2O.下列结论正确的是
的废水至少需要加入a mol FeSO4?7H2O.下列结论正确的是 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
2- 7 |
2- 7 |
2- 7 |
2- 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)若废水中六价铬以![]() 存在,试写出在酸性条件下硫酸亚铁还原
存在,试写出在酸性条件下硫酸亚铁还原![]() 的离子反应方程式并配平:_______________________。
的离子反应方程式并配平:_______________________。
(2)由(1)的结果可确定铁氧磁体中x=__________。
(3)据(2)的结果,若废水中Cr(Ⅵ)按CrO3计,则加入的FeSO4·7H2O与CrO3的质量比应为多少才能除去废水中的Cr(Ⅵ), ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com