
【题目】某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示。
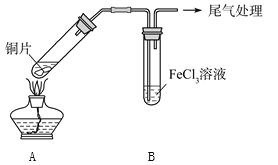
(1)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验。
步骤① | 配制1 mol·L-1FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管B中,加热A |
FeCl3溶液显酸性的原因是__________________。写出装置A中产生SO2的化学方程式:_______________________________。
(2)当SO2通入FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象。将混合液放置12小时,溶液才变成浅绿色。
【查阅资料】[Fe(HSO3)]2+为红棕色,它可以将Fe3+还原为Fe2+。生成
[Fe(HSO3)]2+的反应为可逆反应。
解释SO2与FeCl3溶液反应生成红棕色[Fe(HSO3)]2+的原因:_________________________。
写出溶液中[Fe(HSO3)]2+与Fe3+反应的离子方程式: ________________________。
(3)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了步骤②、③的实验。
步骤② | 往5 mL 1 mol·L-1FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶液颜色变为浅绿色 |
步骤③ | 往5 mL重新配制的1 mol·L-1FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色。几分钟后,发现溶液颜色变成浅绿色 |
用铁氰化钾溶液检验步骤②和步骤③所得溶液中的Fe2+,其现象为____________________。
(4)综合上述实验探究过程,可以获得的实验结论:
Ⅰ.SO2与FeCl3溶液反应生成红棕色中间产物[Fe(HSO3)]2+;
Ⅱ.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
Ⅲ.____________________。
【答案】(1)Fe3++3H2O![]() Fe(OH)3+3H+
Fe(OH)3+3H+
Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(2)H2O+SO2![]() H2SO3
H2SO3![]() H++HSO
H++HSO![]() ,
,
Fe3++HSO![]()
![]() [Fe(HSO3)]2+
[Fe(HSO3)]2+
Fe3++H2O+[Fe(HSO3)]2+===2Fe2++SO![]() +3H+
+3H+
(3)生成蓝色沉淀 (4)加热、提高FeCl3溶液的酸性会缩短浅绿色出现的时间
【解析】(1)FeCl3溶液呈酸性是因为Fe3+的水解,即Fe3++3H2O![]() Fe(OH)3+3H+;装置A利用Cu和浓硫酸加热制取SO2,化学方程式为Cu+2H2SO4(浓)
Fe(OH)3+3H+;装置A利用Cu和浓硫酸加热制取SO2,化学方程式为Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O。(2)该过程中首先有H2O+SO2=H2SO3,然后H2SO3电离:H2SO3=H++HSO
CuSO4+SO2↑+2H2O。(2)该过程中首先有H2O+SO2=H2SO3,然后H2SO3电离:H2SO3=H++HSO![]() ,最后HSO
,最后HSO![]() 和Fe3+发生络合反应生成红棕色[Fe(HSO3)]2+,即Fe3++HSO
和Fe3+发生络合反应生成红棕色[Fe(HSO3)]2+,即Fe3++HSO![]()
![]() [Fe(HSO3)]2+。[Fe(HSO3)]2+与Fe3+发生氧化还原反应,生成Fe2+,离子方程式为Fe3++H2O+[Fe(HSO3)]2+===2Fe2++SO
[Fe(HSO3)]2+。[Fe(HSO3)]2+与Fe3+发生氧化还原反应,生成Fe2+,离子方程式为Fe3++H2O+[Fe(HSO3)]2+===2Fe2++SO![]() +3H+。(3)铁氰化钾与Fe2+反应,生成的是蓝色沉淀Fe3[Fe(CN)6]2。(4)通过以上实验还可推知,升高温度或增加FeCl3溶液的酸性会加快反应速率,缩短浅绿色出现的时间。
+3H+。(3)铁氰化钾与Fe2+反应,生成的是蓝色沉淀Fe3[Fe(CN)6]2。(4)通过以上实验还可推知,升高温度或增加FeCl3溶液的酸性会加快反应速率,缩短浅绿色出现的时间。


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
【题目】某无色溶液中含有:①Na+、②Ba2+、③Cl-、④Br-、⑤SO![]() 、⑥SO
、⑥SO![]() 中的一种或几种,依次进行下列实验,且每步所加的试剂均过量,观察到的现象如下表所示。
中的一种或几种,依次进行下列实验,且每步所加的试剂均过量,观察到的现象如下表所示。
步骤 | 操 作 | 现 象 |
① | 用pH试纸检验 | 溶液的pH大于7 |
② | 向溶液中滴加氯水,再加入CCl4振荡,静置 | CCl4层呈橙色 |
③ | 向②所得溶液中加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀产生 |
④ | 过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
下列实验结论正确的是( )
A.肯定含有的离子是①④⑤
B.肯定没有的离子是②⑤
C.可能含有的离子是①②⑥
D.不能确定的离子是①③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能用H++OH﹣=H2O表示的化学方程式是( )
A.氢氧化钠溶液与醋酸反应
B.氢氧化铁与硫酸反应
C.氢氧化钡与硫酸反应
D.硫酸氢钠与氢氧化钠溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组同学向一定量加入少量淀粉的NaHSO3溶液中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝色。
(1)查阅资料知,NaHSO3与过量KIO3反应分为两步进行,第一步为IO![]() +3HSO
+3HSO![]() ===3SO
===3SO![]() +3H++I-,则第二步反应的离子方程式为________________________。
+3H++I-,则第二步反应的离子方程式为________________________。
(2)通过测定溶液变蓝所用时间探究浓度和温度对该反应的反应速率的影响。调节反应物浓度和温度进行对比实验,记录如下:
实验编号 | 0.02 mol/L NaHSO3溶液/mL | 0.02 mol/L KIO3溶液/mL | H2O/mL | 反应温度/℃ | 溶液变蓝的时间t/s |
① | 15 | 20 | 10 | 15 | t1 |
② | a | 30 | 0 | 15 | t2 |
③ | 15 | b | c | 30 | t3 |
实验①②是探究____________对反应速率的影响,表中a=________;实验①③是探究温度对反应速率的影响,则表中b=________,c=________。
(3)将NaHSO3溶液与KIO3溶液混合(预先加入可溶性淀粉为指示剂),用速率检测仪检测出起始阶段反应速率逐渐增大,一段时间后反应速率又逐渐减小。课题组对起始阶段反应速率逐渐增大的原因提出如下假设,请你完成假设三:
假设一:反应生成的SO![]() 对反应起催化作用,SO
对反应起催化作用,SO![]() 浓度越大反应速率越快;
浓度越大反应速率越快;
假设二:反应生成的H+对反应起催化作用,H+浓度越大反应速率越快;
假设三:__________________________;
……
(4)请你设计实验验证上述假设一,完成下表中内容(反应速率可用测速仪测定)。
实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以磷石膏(主要成分CaSO4,杂质SiO2、Al2O3等)为原料可制备轻质CaCO3,流程图如下。
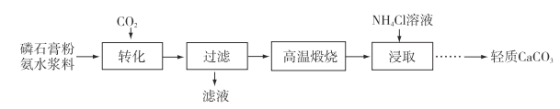
(1)匀速向浆料中通入CO2,浆料清液的pH和c(SO42-)随时间变化见如下图。清液pH>11时CaSO4转化的离子方程式为________;能提高其转化速率的措施有________(填序号)。

A.搅拌浆料
B.加热浆料至100 ℃
C.增大氨水浓度
D.减小CO2通入速率
(2)当清液pH接近6.5时,过滤并洗涤固体。滤液中物质的量浓度最大的两种阴离子为________和__________(填化学式);检验洗涤是否完全的方法是_____________________。
(3)在敞口容器中,用NH4Cl溶液浸取高温煅烧的固体,随着浸取液温度上升,溶液中c(Ca2+)增大的原因是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关现象及对应的离子方程式或化学反应方程式不正确的是
A.草酸溶液可使酸性高锰酸钾溶液褪色:MnO4-+C2O42-+16H+=Mn2++2CO2↑+8H2O
B.在酸性环境中不存在 S2O32-:S2O32-+2H+=S↓+SO2↑+H2O
C.K2Cr2O7在水中存在平衡:Cr2O72-+H2O![]() 2CrO42-+2H+,可由溶液颜色判断其酸碱性
2CrO42-+2H+,可由溶液颜色判断其酸碱性
D.SOCl2是一种液态化合物,遇水有雾及刺激性气味气体产生,其化学反应方程式为
SOCl2+H2O=2HCl↑+SO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.1mol任何气体的体积都约是22.4L
B.lmolH2和O2的混合气体,在标准状况下的体积约为22.4L
C.lmol H2气态物质,当体积为22.4L时,该气体一定处于标准状况
D.标准状况下,2molH2O体积约为44.8L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com