
| A、同周期元素的第一电离能从左往右越来越大 |
| B、同主族元素从上到下第一电离能越来越大 |
| C、同周期元素的电负性从左往右越来越大 |
| D、同主族元素从上到下电负性越来越大 |


科目:高中化学 来源: 题型:
| 离子 | K+ | Na+ | SO42- | NO3- |
| 浓度/mol?L-1 | 2×10-6 | 3×10-6 | 2×10-5 | 1.5×10-5 |
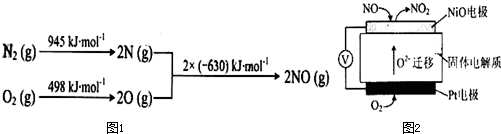
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.5 mol?L-1 |
| B、0.2 mol?L-1 |
| C、0.1 mol?L-1 |
| D、0.9 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、16.0g |
| B、19.2g |
| C、24.0g |
| D、30.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:
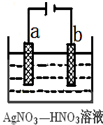 金属冶炼和处理常涉及氧化还原反应.
金属冶炼和处理常涉及氧化还原反应.查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1800 | 2700 | 11600 |
| A、元素Y的常见化合价是+3价 |
| B、元素X是ⅠA族的元素 |
| C、元素X与氧形成化合物时,化学式可能是X2O2 |
| D、若元素Y处于第3周期,它可与冷水剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl-、SO42-、OH-、H+ |
| B、SO42-、Cl-、OH-、H+ |
| C、Cl-、SO42-、OH-、CO2 |
| D、OH-、Cl-、SO42-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、雾是由大量悬浮在近地面空气中的微小水滴或冰晶组成的气溶胶,多出现于秋冬季节 |
| B、焚烧秸秆和化石燃料的燃烧会增大空气中PM2.5的含量 |
| C、PM2.5在空气中一定能产生丁达尔现象 |
| D、开发利用新能源,实施“低碳经济”,可减少PM2.5的产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com