
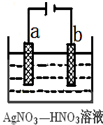
 金属冶炼和处理常涉及氧化还原反应.
金属冶炼和处理常涉及氧化还原反应.

科目:高中化学 来源: 题型:
 保险粉(Na2S2O4)有极强的还原性,遇水或在潮湿空气中会分解发热,甚至引起燃烧,但在碱性环境下较稳定.某实验小组利用如图装置制取保险粉,并验证其还原性.在35~45℃下,将SO2气体通入锌粉-水悬浮液中,生成ZnS2O4;待反应完全后,冷却至室温,向三颈烧瓶中加入18%的NaOH溶液,生成Na2S2O4和Zn(OH)2;经一系列操作获得无水Na2S2O4样品.
保险粉(Na2S2O4)有极强的还原性,遇水或在潮湿空气中会分解发热,甚至引起燃烧,但在碱性环境下较稳定.某实验小组利用如图装置制取保险粉,并验证其还原性.在35~45℃下,将SO2气体通入锌粉-水悬浮液中,生成ZnS2O4;待反应完全后,冷却至室温,向三颈烧瓶中加入18%的NaOH溶液,生成Na2S2O4和Zn(OH)2;经一系列操作获得无水Na2S2O4样品.查看答案和解析>>
科目:高中化学 来源: 题型:
 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(B)=0.75 mol?L-1?s-1 |
| B、z=2 |
| C、B的转化率为25% |
| D、C的体积分数约为28.6% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同周期元素的第一电离能从左往右越来越大 |
| B、同主族元素从上到下第一电离能越来越大 |
| C、同周期元素的电负性从左往右越来越大 |
| D、同主族元素从上到下电负性越来越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是测定镁粉(含铝粉)的纯度的实验装置.所用的NaOH浓度为4.6mol?L-1.
如图是测定镁粉(含铝粉)的纯度的实验装置.所用的NaOH浓度为4.6mol?L-1.| 实验操作 | 时间/min | 电子天平的读数/g |
| 烧杯+NaOH溶液 | 120 | |
| 烧杯+NaOH溶液+样品 | 0 | 135.6 |
| 1 | 135.1 | |
| 2 | 134.7 | |
| 3 | 134.4 | |
| 4 | 134.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 高温 |
| A、CO的平均消耗速率为0.3 mol?L-1?min-1 |
| B、5 min后,气体的总物质的量浓度为2mol?L-1 |
| C、若单位时间内生成H2和H2O的物质的量之比为1:1,则体系处于平衡状态 |
| D、平衡后,增大压强,平衡将向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④ | B、③④⑦ |
| C、②③ | D、①⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②④ | B、③④⑤ |
| C、②③④ | D、②③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com