
【题目】短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,a的一种重要用途为清洁能源,d是淡黄色粉末,m为元素Y的单质,通常为无色无味的气体。上述物质的转化关系如图所示。下列说法错误的是( )
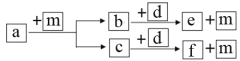
A.简单离子半径:Z<Y
B.阴离子的还原性:Y>W
C.简单气态氢化物的热稳定性:Y>X
D.W2Y2中含有非极性键
【答案】B
【解析】
由d是淡黄色粉末可知,d为过氧化钠,结合题给物质的转化关系可知a为甲烷、m为氧气,甲烷在氧气在燃烧生成二氧化碳和水,二氧化碳与过氧化钠反应生成碳酸钠和氧气,水与过氧化钠反应生成氢氧化钠和水,由短周期元素W、X、Y、Z的原子序数依次递增可知,W为H元素、X为C元素、Y为O元素、Z为Na元素。
A.钠离子和氧离子具有相同的电子层结构,电子层结构相同的离子,随核电荷数增大,离子半径减小,则钠离子的离子半径小于氧离子,故A正确;
B.元素的非金属性越强,单质的氧化性越强,对应离子的还原性越弱,氧元素的非金属性强于氢元素,则负一价氢离子还原性强于氧离子,故B错误;
C.元素的非金属性越强,简单气态氢化物的热稳定性越大,氧元素非金属性强于碳元素,则水比甲烷稳定,故C正确;
D.过氧化钠为离子化合物,化合物中含有离子键和非极性键,故D正确;
故选B。


科目:高中化学 来源: 题型:
【题目】六氟磷酸钠(NaPF6)极易溶于水,可溶于乙醇、丙酮等有机溶剂,可作高能钠电池的电解质。工业上以氟磷灰石[Ca5(PO4)3F]、NaCl为主要原料,制备六氟磷酸钠的工艺流程如下:
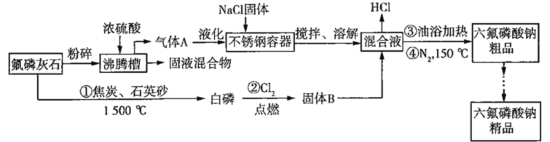
已知:HF的熔点为-83 ℃,沸点为19.5 ℃。回答下列问题:
(1)氟磷灰石粉碎的目的是_______________。
(2)HF液化时产生的二聚物(HF)2能发生微弱的电离,与NaCl反应生成NaHF2,请写出该二聚物的电离方程式:________。
(3)为避免废水NaH2PO4的污染,常在其中加入石灰,将磷元素全部转化成磷酸钙,进行回收利用。已知常温下Ksp[Ca3(PO4)2]=1.96×10-29,当处理后的废水c(Ca2+)=1.0×10-5 mol/L时,则溶液中c(![]() )=___________mol/L。
)=___________mol/L。
(4)操作③油浴加热目的是________。
(5)反应①中除生成白磷(P4)外,还产生SiF4和一种还原性气体,写出该反应的化学方程式:______。
(6)六氟磷酸钠粗品的提纯:将六氟磷酸钠粗品(杂质主要是微量铁盐)溶于一定量乙醇中,加入适量5%的NaOH甲醇溶液,使溶液保持碱性,离心将不溶杂质除去。通过______(填操作方法)将溶剂回收,减压条件下结晶,得到NaPF6·H2O,干燥得到无水盐。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对分子的性质的解释中,正确的是( )

A.常温下水很稳定(1000℃以上才会部分分解),因为水中含有大量氢键
B.![]() 该分子含有1个手性碳原子
该分子含有1个手性碳原子
C.含有极性键的分子一定是极性分子
D.由图知酸性:H3PO4>HClO,因为H3PO4的非羟基氧原子数大于次氯酸的非羟基氧原子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.饱和Na2CO3溶液与CaSO4固体反应:CO![]() +CaSO4=CaCO3+SO
+CaSO4=CaCO3+SO![]()
B.酸化NaIO3和NaI的溶液混合:I-+IO![]() +6H+=I2+3H2O
+6H+=I2+3H2O
C.KClO碱性溶液与Fe(OH)3反应:3ClO-+2Fe(OH)3=2FeO![]() +3Cl-+4H++H2O
+3Cl-+4H++H2O
D.电解饱和食盐水:2Cl-+2H+![]() Cl2↑+H2↑
Cl2↑+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
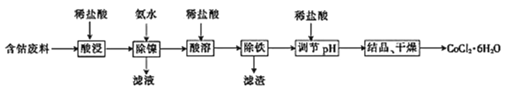
【题目】常温下,用含钴废料(主要成分为CoCO3,还含有少量NiCO3与铁屑)制备CoCl26H2O的工艺流程如图。
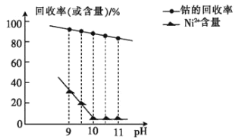
①已知除镍过程中溶液pH对钴的回收率及Ni2+含量的影响如图所示。
②部分金属阳离子在实验条件下开始沉淀和完全沉淀的pH如表所示:
金属阳离子 | 开始沉淀pH | 完全沉淀pH |
Fe3+ | 1.5 | 4.0 |
Fe2+ | 7.5 | 9.7 |
Co2+ | 6.6 | 9.4 |
Ni2+ | 7.7 | 9.5 |
回答下列问题:
(1)酸浸后溶液中的阳离子为:Co2+,Ni2+和__。
(2)除镍时,应调节溶液pH=__,此时Ni2+是否形成Ni(OH)2沉淀?___(是或否)。若pH过小,则产品纯度会___(升高,降低,或不变)。
(3)酸溶时,当调节pH=8时,溶液中n(Fe3+):n(Co2+)=__。
已知Ksp[Co(OH)2]=2.0×10-16,Ksp[Fe(OH)3]=4.0×10-38。
(4)除铁时先向溶液中加入30%的H2O2发生的离子反应方程式是:__。充分反应后再向溶液中加入CoCO3,调节溶液pH范围为__,使Fe3+完全转化为Fe(OH)3沉淀,最后过滤得到CoCl2溶液。
(5)已知Ag++SCN-=AgSCN↓,为测定粗产品中CoCl26H2O的含量,称取11.9g粗产品配成100mL溶液,从中取出25mL先加入含0.03mol的AgNO3,(杂质不与其反应),再用0.5mol/L的KSCN溶液标定过量的AgNO3,该标定操作所用的指示剂为__(填化学式),若消耗20.00mL的KSCN溶液,则该粗产品中CoCl26H2O的质量分数为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
在不同温度、压强和相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数(φ)如图所示。
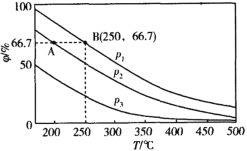
①其中,p1、p2和p3由大到小的顺序是___,其原因是___。
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)___vB(N2)(填“>”“<”或“=”)。
③若在250℃、p1为105Pa条件下,反应达到平衡时容器的体积为1L,则该条件下B点N2的分压p(N2)为___Pa(分压=总压×物质的量分数,保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案不能达到相应目的的是( )
目的 | A.验证牺牲阳极的阴极保护法 | B.研究浓度对FeCl3水解平衡的影响 |
实验方案 |
|
|
目的 | C.比较CH3COOH和H3BO3(硼酸)酸性的强弱 | D.比较AgCl和AgI溶解度的大小 |
实验方案 |
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂可用于氮的固定,其转化过程如图所示。下列说法错误的是
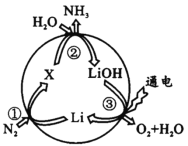
A.反应①中N2是氧化剂
B.反应②属于复分解反应
C.转化过程中涉及的H2O、LiOH都属于电解质
D.反应③中Li在阳极生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种不同堆积方式的金属晶体的晶胞如图所示,下列有关说法正确的是( )
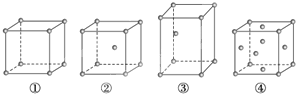
A. ①为简单立方堆积,②为镁型,③为钾型,④为铜型
B. 每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个
C. 晶胞中原子的配位数分别为:①6,②8,③8,④12
D. 空间利用率的大小关系为:①<②<③<④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com