
 ������H+�ŵ�����H2��c��H+����С��ˮ�ĵ���ƽ�������ƶ���������ǿ��
������H+�ŵ�����H2��c��H+����С��ˮ�ĵ���ƽ�������ƶ���������ǿ��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ϡ�ͺ���Һ��c(H+)��c(OH-)����С |
| B��ϡ�ͺ���Һ��c(OH-)��Ϊϡ��ǰ��1/10 |
| C��ϡ�����а�ˮ�ĵ���ƽ�������ƶ� |
D��ϡ��������Һ��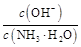 ���� ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��(NH4)2SO4��Һ�� c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| B��Na2Sϡ��Һ�� c(Na+)��c(S2-)+c(H2S)+c(HS-) |
| C������ʳ��ˮ�� c(Na+)+c(H+)��c(Cl-)+c(OH-) |
| D��CH3COOH��Һ��ˮϡ�ͺ���Һ����������Ũ�ȶ���С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���ڢޢ� | B���ۢܢޢ� | C���ۢܢݢ� | D���٢� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����Һ�е������ӵ���Ŀ���ӣ���������ǿ |
| B������ĵ���̶�����c(H+)������ |
| C���ټ���10 m L pH="11" NaOH��Һ�����ҺpH=7 |
D����Һ��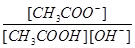 ���� ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ˮ�������c(H��)����>��>�� |
| B����Һ��pH����>��>�� |
| C���ٺ͢ڵ������Ϻ����Һ��c(Na+)=c(H2CO3)+c(HCO3��)+c(CO32��) |
| D���ٺ͢۵������Ϻ����Һ��c(Na+)>c(HCO3��)>c(CO32��)>c(OH��)>c(H+) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��c(NH4+)����>�� |
| B��ˮ�������c(H��)����>�� |
| C���ٺ͢ڵ������Ϻ����Һ��c(H��)��c(OH��)��c(NH3��H2O) |
| D���ٺ͢۵������Ϻ����Һ��c(NH4+)>c(Cl��)>c(OH��)>c(H��) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| �� | ���볣�� |
| ̼�� | K1��4��10��7 K2��5.6��10��11 |
| ������ | K1��1.54��10��2 K2��1.02��10��7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
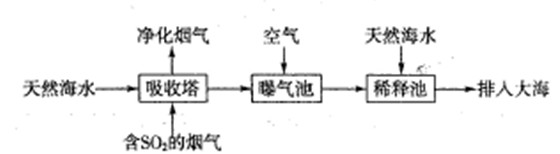
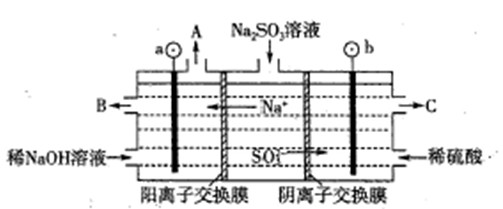
 H++SO42-��
H++SO42-���鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com