

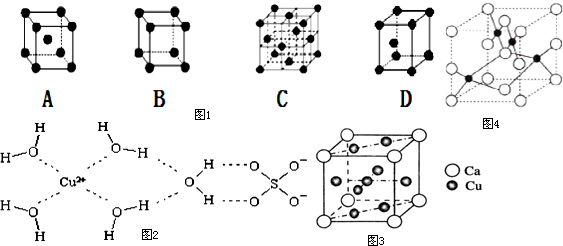
分析 (1)铜是立方最密堆积,据此判断;
(2)根据胆矾晶体的结构图可知,在晶体中水分子与铜离子之间是配位键,氢氧之间是极性共价键,硫酸根和铜离子之间为离子键,水分子与水分子之间有氢键,据此答题;
(3)利用均摊法计算;根据晶胞结构判断;
(4)氢氧化铜能与氨水形成铜氨配合离子而溶于水,铜离子可以与四个氨分子形成配合离子,据此答题;
(5)根据V=$\frac{m}{ρ}$计算出体积.
解答 解:(1)铜是立方最密堆积,故选C;
(2)根据胆矾晶体的结构图可知,在晶体中水分子与铜离子之间是配位键,氢氧之间是极性共价键,硫酸根和铜离子之间为离子键,水分子与水分子之间有氢键,
故选ABC;
(3)利用均摊法计算可知,晶胞中Ca位于定点,N(Ca)=8×$\frac{1}{8}$=1,Cu位于面心和体心,共有N(Cu)=8×$\frac{1}{2}$+1=5,则该合金中Ca和Cu的原子个数比为1:5,根据晶胞结构可知,晶胞中与Ca距离最近的Ca原子分布在晶胞上与之相邻的顶点上,这样的Ca原子有6个,
故答案为:1:5;6;
(4)氢氧化铜能与氨水形成铜氨配合离子而溶于水,铜离子可以与四个氨分子形成配合离子,其空间结构图为: ,
,
故答案为: ;
;
(5)根据均摊法可知,在每个晶胞中含有铜原子数为$8×\frac{1}{8}+6×\frac{1}{2}$=4,氧原子数为4,根据V=$\frac{m}{ρ}$可计算出体积$\frac{\frac{4×(16+64)}{N{\;}_{A}}}{a}$cm3=$\frac{320}{a{N}_{A}}$cm3,
故答案为$\frac{320}{a{N}_{A}}$.
点评 本题主要考查晶胞的结构、配合物结构及晶胞的计算等知识,有一定的综合性,中等难度.


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②③④ | C. | ②③ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2CH4(g)+4O2(g)═2CO2(g)+4H2O(l)△H=+890 kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890 kJ•mol-1 | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890 kJ•mol-1 | |
| D. | 2CH4(g)+4O2(g)═2CO2(g)+4H2O(l)△H=-890 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
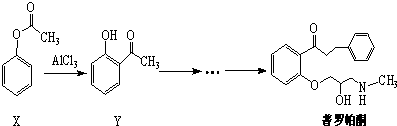
| A. | 可用溴水或FeCl3溶液鉴别X和Y | |
| B. | 反应物X与中间体Y互为同系物 | |
| C. | 普罗帕酮分子中有2个手性碳原子 | |
| D. | X、Y和普罗帕酮都能发生加成、水解、氧化、消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R是第三周期第ⅤA族的元素 | |
| B. | R的最高正化合价是+5 | |
| C. | R的氢化物分子式是RH5 | |
| D. | R的最高价氧化物的水化物的水溶液呈酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PbO2 为正极,被氧化 | |
| B. | 电解质溶液中 c(H+) 逐渐增大 | |
| C. | 电池电解质溶液的密度不断减小 | |
| D. | 该电池的负极反应式为:Pb-2e-═Pb2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
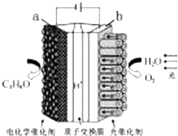 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化 为O2和燃料(C3H8O).下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化 为O2和燃料(C3H8O).下列说法正确的是( )| A. | 该装置将化学能转化为光能和电能 | |
| B. | 该装置工作时,H+从b极区向a极区迁移 | |
| C. | 每生成1 mol O2,有44 g CO2被还原 | |
| D. | a 电极的反应为:3CO2+18H+-18e-═C3 H8O+5 H2 O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
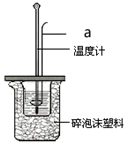 利用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液,在如图所示装置中测定中和热,回答下列问题:
利用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液,在如图所示装置中测定中和热,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 1 mol/L CH3COONa溶液中存在NA个CH3COO- | |
| B. | 标况下,22.4L 甲醇中所含原子数一定为6NA | |
| C. | 1mol CnH2n+2含有(3 n+1)NA个共价键 | |
| D. | 0.1mol羟基含有的电子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com