
为使Fe2+、Fe3+、Zn2+较完全地形成氢氧化物沉淀,溶液的酸碱度分别为pH 7.7、pH 4.5、pH 6.6。某硫酸锌酸性溶液中含有少量Fe2+、Fe3+杂质离子,为除去这些离子制得纯净的ZnSO4,应加入的试剂是( )
A.H2O2,ZnO B.氨水
C.KMnO4,ZnCO3 D.NaOH溶液
科目:高中化学 来源: 题型:
氮化钠(Na3N)是科学家制备的一种重要化合物,它与水作用可产生NaOH和NH3。请回答下列问题:(1)Na3N的电子式是__________;该化合物是由__________键形成的__________(填“离子”或“共价”)化合物。
(2)Na3N与盐酸反应生成__________种盐,对应的反应方程式是 。
(3)比较Na3N中两种微粒的半径:r(Na+)__________r(N3-)(填“>”“=”“<”符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
物质的结构决定性质,性质反映其结构特点。
(1)金刚石和石墨是碳元素的两种常见单质,下列叙述中正确的有
a.金刚石中碳原子的杂化类型为sp3杂化,石墨中碳原子的杂化类型为sp2杂化;
b.晶体中共价键的键长:金刚石中C—C<石墨中C—C;
c.晶体的熔点:金刚石< 石墨
d.晶体中共价键的键角:金刚石>石墨
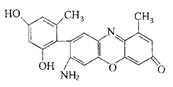 (2)某石蕊的分子结构如右图所示。
(2)某石蕊的分子结构如右图所示。
①石蕊分子所含元素中,基态原子2p轨道有两个成单电子的是 (填元素符号); 由其中两种元素形成的三角锥构型的一价阳离子是 (填化学式);
②该石蕊易溶解于水,分析可能的原因是 ;
(3)铜及其合金是人类最早使用的金属材料。
①NF3可由NH3和F2在Cu催化剂存在下反应直接得到:4NH3+3F2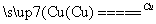 NF3+3NH4F
NF3+3NH4F
 上述化学方程式中的5种物质所属的晶体类型有_______(填序号)。
上述化学方程式中的5种物质所属的晶体类型有_______(填序号)。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
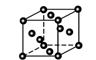
②金属铜采取如图所示堆积方式,可称为_____堆积,则Cu晶体中
Cu原子的配位数为
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中发生反应:2X(g)+Y(g)aZ(g) ΔH=Q kJ·mol-1,开始按体积比2∶1将X、Y充入反应器中,一定条件下发生反应。图甲和图乙是根据反应绘制的图象,下列有关说法正确的是( )

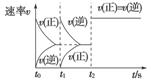
甲 乙
A.图甲,p1>p2,a<3
B.图甲,T1<T2,Q>0
C.图乙,t1时表示恒温、恒压条件下,向平衡体系中充入一定量的Z气体
D.图乙,如果a=3,t2时表示向体系中加入了催化剂或增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可表示平衡常数(记作Kp),则反应CH4(g)+H2O(g)CO(g)+3H2(g) ΔH=206.2 kJ·mol-1的Kp=________,随着温度的升高,该平衡常数________(填“增大”“减小”或“不变”)。
(2)(天津高考)写出WO3(s)+3H2(g) W(s)+3H2O(g)的化学平衡常数表达式为________。
W(s)+3H2O(g)的化学平衡常数表达式为________。
(3)(福建高考)在恒容绝热(不与外界交换能量)条件下进行2A(g)+B(g)2C(g)+D(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。简述该反应的平衡常数与温度的变化关系:________。
| 物质 | A | B | C | D |
| 起始投料/mol | 2 | 1 | 2 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C是所学过的三种单质,A、B、C及其他 物质之间的反应关系如图91所示,其中B、D、E、F的水溶液呈酸性。若D+C→E+F且常温下只有B为气态,则A、B、C分别为( )
物质之间的反应关系如图91所示,其中B、D、E、F的水溶液呈酸性。若D+C→E+F且常温下只有B为气态,则A、B、C分别为( )
A.Fe、Cl2、Cu B.Fe、Cl2、H2
C.Cu、Cl2、Fe D.Fe、Cl2、Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组的同学欲测定该补血剂中铁元素的含量。实验步骤如下:

图95
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是:取样,先滴加KSCN溶液,再滴加____________,该过程的现象为________________________。
(2)步骤②加入过量H2O2的目的是________________________________________________________________________
________________________________________________________________________。
(3)步骤③中反应的离子方程式是________________________________________________________________________
________________________________________________________________________。
(4)步骤④中一系列处理的操作步骤:过滤、________________________________________________________________________、
灼烧、________、称量。
(5)若实验中铁无损耗,则每片补血剂中含铁元素的质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
可以用来鉴别己烯、甲苯、乙酸乙酯、苯酚溶液的一组试剂是
A.氯化铁溶液、溴水 B.碳酸钠溶液、溴水
C.溴水、酸性高锰酸钾溶液 D.酸性高锰酸钾溶液、氯化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
钢铁等铁制品是应用最广泛的金属材料,铁元素的单质及其化合物在元素化合物世界始终扮演着重要角色。
Ⅰ.打磨过的细铁丝可在纯氧中剧烈燃烧,最终生成黑色固体,其化学式为______________;铁粉与水蒸气在高温下也可生成该黑色固体,反应的化学方程式为________________________________________________________________________。
Ⅱ.某校探究性学习小组用已部分生锈的废铁屑制作印刷电路板的腐蚀剂,并回收铜。探究过程如图94所示。

图94
请回答下列问题:
(1)步骤①中先加入热的Na2CO3溶液除油污,操作甲的名称是________________。
(2)步骤②中,除发生反应Fe+2HCl===FeCl2+H2↑外,其他可能反应的离子方程式为________________________________。
(3)溶液C的颜色是__________,溶液D中可能含有的金属阳离子有____________________。
(4)若溶液B中只含有Fe2+而不含Fe3+,可证明该事实的实验方法是__________。
①先加氯水,后加KSCN溶液后显红色;
②先加KSCN溶液,不显红色,再加氯水后显红色;
③滴加NaOH溶液,先产生白色沉淀,迅速变为灰绿色,最后呈红褐色;
④只滴加KSCN溶液不显红色。
A.①② B.②③
C.③④ D.①④
(5)步骤⑤产生金属铜的化学方程式为________________________________________________________________________
________________________________________________________________________。
Ⅲ.金属的腐蚀所导致的钢铁损耗占钢铁年产量的1/4还多。在钢铁的吸氧腐蚀过程中,正极反应式为________________________________________________________________________,
若此过程中共生成了8 g Fe2O3,则转移的电子的物质的量为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com