
| A. | 0.1mol•L-1的NaHS溶液中:c(OH-)=c(H+)+c(H2S) | |
| B. | 往氯化铵溶液中加水$\frac{c({H}^{+})•c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$的值变大 | |
| C. | 0.1mol•L-1的NaOH溶液与0.2mol•L-1的HA溶液等体积混合,所得溶液呈现碱性:c(Na+)>c(HA)c(A-)>c(OH-)>c(H+) | |
| D. | pH相等的①NH4Cl②NH4Al(SO4)2③NH4HSO4溶液中,c(NH4+)大小顺序:①>②>③ |
分析 A.溶液呈存在电荷守恒核和物料守恒,根据电荷守恒和物料守恒判断;
B.根据$\frac{c({H}^{+})•c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$=$\frac{c({H}^{+})•c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$×$\frac{c(O{H}^{-})}{c(O{H}^{-})}$=$\frac{{K}_{w}}{{K}_{b}}$分析;
C.反应后溶质为等浓度的NaA、HA的混合物,溶液呈碱性,说明A-的水解程度大于HA的电离程度,则c(A-)<c(HA);根据物料守恒可知c(HA)>c(Na+)>c(A-);
D.硫酸氢铵在溶液中完全电离出氢离子,pH相同时其浓度最小;硫酸铝铵溶液中铵根离子和铝离子都发生水解,pH相同时硫酸铝铵溶液的浓度小于氯化铵,结合铵根离子的水解程度较小分析.
解答 解:A.溶液中存在电荷守恒c(OH-)+2c(S2-)+c(HS-)=c(H+)+c(Na+),存在物料守恒c(H2S)+c(S2-)+c(HS-)=c(Na+),所以得c(OH-)+c(S2-)=c(H+)+c(H2S),故A错误;
B.设一水合氨的电离平衡常数为kb,则$\frac{c({H}^{+})•c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$=$\frac{c({H}^{+})•c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$×$\frac{c(O{H}^{-})}{c(O{H}^{-})}$=$\frac{{K}_{w}}{{K}_{b}}$,由于水的离子积和一水合氨的电离平衡常数不变,则加水过程中该比值不变,故B错误;
C.0.1mol•L-1的NaOH溶液与0.2mol•L-1的HA溶液等体积混合,溶质为等浓度的NaA、HA的混合物,所得溶液呈现碱性:c(OH-)>c(H+),则c(A-)<c(HA),根据物料守恒可知c(HA)>c(Na+)>c(A-),溶液中正确的离子浓度大小为:c(HA)>c(Na+)>c(A-)>c(OH-)>c(H+),故C错误;
D.pH相等的①NH4Cl②NH4Al(SO4)2③NH4HSO4溶液中,NH4HSO4在溶液中完全电离出氢离子,pH相同时③的浓度最小;NH4Al(SO4)2中的铝离子、铵根离子都发生水解,浓度相同时②溶液的氢离子浓度大于①,则pH相同时②的浓度大于①,由于铵根离子水解程度较小,则c(NH4+)大小顺序:①>②>③,故D正确;
故选D.
点评 本题考查了离子浓度大小比较,涉及物质间的反应、盐类水解和弱电解质的电离,题目难度中等,明确溶质的性质是解本题关键,再结合电荷守恒、物料守恒解答,试题培养了学生的分析能力及灵活应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

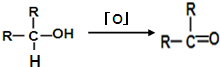
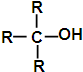

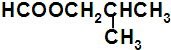 、
、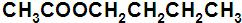 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

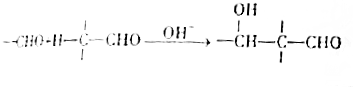
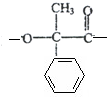
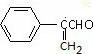 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$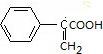 +Cu2O+2H2O
+Cu2O+2H2O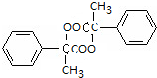
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知:0.4mol液态N2H4与足量的液体双氧水反应,生成氮气和水蒸气,放出200.0kJ的热量.
已知:0.4mol液态N2H4与足量的液体双氧水反应,生成氮气和水蒸气,放出200.0kJ的热量.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂,但不能导电.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.关于这两种晶体的说法,正确的是( )
氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂,但不能导电.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.关于这两种晶体的说法,正确的是( )| A. | 立方相氮化硼含配位键B→N | |
| B. | 六方相氮化硼层间作用力小,所以质地软,熔点低 | |
| C. | 两种氮化硼中的硼原子都是采用sp2杂化 | |
| D. | 六方相氮化硼晶体其结构与石墨相似却不导电,原因是没有可以自由移动的电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com