
下列有关阿伏伽德罗常数NA说法错误的是
A.22 g 2H218O中含有的质子数为10NA
B.电解58.5 g熔融的NaCl,能产生11.2 L氯气(标准状况)、23.0 g金属钠
C.1.00 mol NaCl中,所有Na+的最外层电子总数为10NA
D.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源:2015-2016学年广东深圳高级中学高一上期中考试化学试卷(解析版) 题型:选择题
要从硝酸钾和食盐(少量)的混合物中,分离出较纯净的硝酸钾,应把它们( )
A.溶解、过滤
B.制成热的硝酸钾饱和溶液,降温后再过滤
C.制成溶液后直接蒸干
D.先溶解、再蒸发结晶,趁热过滤
查看答案和解析>>
科目:高中化学 来源:2016届云南师大附中高考适应性月考(四)理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数,下列叙述正确的是
A.红磷在氯气中反应,1mol红磷失去的电子数一定为5NA
B.标准状况下22.4L C3H8中含中子数为18NA
C.1L 1mol/L的葡萄糖溶液中,含有的分子数为NA个
D.常温下78 g过氧化钠和122 g水混合,所得溶液质量分数为40%
查看答案和解析>>
科目:高中化学 来源:2016届山西平遥中学等重点中学高三第三次练兵化学试卷(解析版) 题型:选择题
黄浦江上游水质污染较为严重,相关自来水厂采用多种方法并用的方式进行水质处理,下列说法中错误的是
A.加活性炭吸附水中小颗粒物,净化水质的方法属于物理方法
B.海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等
C.用细菌和酶的扩充法去除水中的氨氮的方法属于生物法
D.用聚合硫酸铁作为净水剂,该处理过程中仅发生了化学变化
查看答案和解析>>
科目:高中化学 来源:2016届宁夏回族自治区银川一中高三上第四次月考理化学试卷(解析版) 题型:填空题
扁桃酸衍生物是重要的医药中间体,以A和B 为原料合成扁桃酸衍生物F路线如下:

(1)A的分子式为C2H2O3,可发生银镜反应,且具有酸性,A所含官能团名称为:_______;写出A+B→C的化学反应方程式为__________________________。
(2)C中 ①、②、③3个—OH的酸性由强到弱的顺序是: _____________。
①、②、③3个—OH的酸性由强到弱的顺序是: _____________。
(3)E是由2分子C生成的含有3个六元环的化合物,E的分子中不同化学环境的氢原子有________种。
(4)D→F的反应类型是__________,1mol F在一定条件下与足量NaOH溶液反应,最多消耗NaOH的物质的量为:________mol。
写出符合下列条件的F的所有同分异构体(不考虑立体异构)的结构简式:_______________。
①属于一元酸类化合物;②苯环上只有2个取代基且处于对位,其中一个是羟基。
(5)写出D在稀NaOH溶液中的反应消耗NaOH的物质的量是____mol。
查看答案和解析>>
科目:高中化学 来源:2016届河北正定中学高三上学期第五次月考理科综合化学试卷(解析版) 题型:填空题
汽车在现代生活中扮演着越来越重要的角色,但其尾气(碳氢化合物、氮氧化物及一氧化碳等)带来的环境污染越来越明显,汽车尾气的治理已经迫在眉睫。
(1)尾气中的CO主要来自于汽油的不完全燃烧。
①有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g) ΔH= +221kJ·mol-1,简述该设想能否实现______(填“是”或“否”)依据是:_______________________________________。
②研究表明:反应CO(g)+H2O(g) H2(g)+CO2(g)平衡常数随温度的变化如下表所示:
H2(g)+CO2(g)平衡常数随温度的变化如下表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
该反应的ΔH______0(填“>”或“<”)若反应在500℃时进行,设起始时CO和H2O的浓度均为0.020mol·L﹣1,在该条件下达到平衡时,CO的转化率为 。
(2)用CO做燃料电池电解NaCl溶液、FeCl3和FeCl2混合液的示意图如图1所示,其中A、B、D均为石墨电极,C为铜电极,转移0.4mol e-后,断开K。

①乙中产生的气体在标准状况下的体积为 。
②丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图2所示,反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要 mL 5.0mol·L﹣1 NaOH溶液。
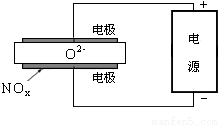
(3)电解法处理氮氧化合物是目前大气污染治理的一个新思路,原理是将NOx在电解池中分解成无污染的N2和O2除去,如图示,两电极间是固体氧化物电解质,在一定条件下可自由传导O2-,电解池阴极反应为__________________。
(4)尾气中的碳氢化合物,如甲烷,可以用来制备氢气。其反应方程式为:
CH4(g)+H2O(g) CO(g)+3H2(g) ΔH = +206.2kJ/mol [其中投料比n(CH4):n(H2O)=1:1]。对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可表示平衡常数(记作KP,分压=总压×物质的量分数)。平衡时CH4的转化率与温度、压强(总压)的关系如图所示:
CO(g)+3H2(g) ΔH = +206.2kJ/mol [其中投料比n(CH4):n(H2O)=1:1]。对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可表示平衡常数(记作KP,分压=总压×物质的量分数)。平衡时CH4的转化率与温度、压强(总压)的关系如图所示:
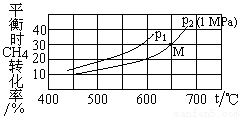
则p1__ p2 (填“>”或“<”),p2时M点的平衡常数KP=________(小数点后保留3位)。
查看答案和解析>>
科目:高中化学 来源:2016届福建省三明市高三上学期第二次月考化学试卷(解析版) 题型:填空题
氢气是一种理想的“绿色能源”,下图为氢能产生与利用的途径
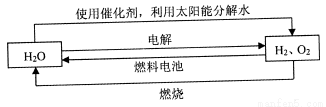
(1)上图中4个过程中能量转化形式有_____________。
A.2种B.3种C.4种D.4种以上
(2)电解过程要消耗大量电能,而使用微生物作催化剂在阳光下即可分解

以上反应的△H1_____________△H2 (选填“>"、“<”或“=”)。
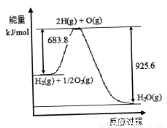
(3)已知H2 O(1)→H2 O(g)△H= +44 mol·L-1,依据右图能量变化写出氢气燃烧生成液态水的热化学方程式________________________________。
(4)氢能利用需要选择合适的储氢材料
①镧镍合金在一定条件下可吸收氢气形成氢化物:LaNi5(s)+3H2(g) LaNi5H6(s) △H<0,欲使
LaNi5H6(s) △H<0,欲使 LaNi5H6 (s)释放出气态氢,根据平衡移动原理,可改变的条件之一是___________。
LaNi5H6 (s)释放出气态氢,根据平衡移动原理,可改变的条件之一是___________。
②一定条件下,如图所示装置可实现有机物的电化学储氢,总反应:2C7 H8+6 H2O(1) 2C7 H14+3O2 (g) 电解过程中产生的气体X为_________,电极A发生的电极反应式为____________。
2C7 H14+3O2 (g) 电解过程中产生的气体X为_________,电极A发生的电极反应式为____________。
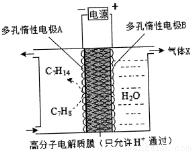
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高二12月月考化学卷(解析版) 题型:填空题
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
[实验设计] 控制p-CP的初始浓度相同,恒定实验温度在298 K或313 K(其余实验条件见下表),设计如下对比实验:
(1)请完成以下实验设计表(表中不要留空格)
实验编号 | 实验目的 | T/K | pH | c/10-3 mol·L-1 | |
H2O2 | Fe2+ | ||||
① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
② | 探究温度对降解反应速率的影响 | 3 | |||
③ | 298 | 10 | 6.0 | 0.30 | |
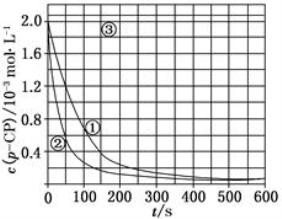
[数据处理] 实验测得p-CP的浓度随时间变化的关系如上图
(2)请根据上图实验①曲线,计算降解反应50~150 s内的反应速率:
v(p-CP)=_______mol·L-1·s-1;
[解释与结论]
(3)实验①、②表明温度升高,降解反应速率增大。但后续研究表明:温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:_____________;
(4)实验③得出的结论是:pH等于10时,反应 (填“能”或“不能”)进行;
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法: 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高一上期中测试化学试卷(解析版) 题型:填空题
4.35 g二氧化锰能与足量浓盐酸(密度为1.19g•cm﹣3、质量分数为36.5%)完全反应。求:
(1)浓盐酸中HCl的物质的量浓度:c(HCl)= 。
(2)被氧化的HCl的物质的量:n(HCl)= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com