
 (1)用0.1026mol?L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如图1所示,此时的读数为
(1)用0.1026mol?L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如图1所示,此时的读数为
| 0.2mol/L |
| 2 |
 ,
, ;
; .
.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、1:1:1 |
| B、6:2:3 |
| C、4:3:18 |
| D、2:1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等物质的量的N2和CO所含分子数均为NA |
| B、1 mol Na2O2 固体中含离子总数为4 NA |
| C、1.7 g H2O2中含有的电子数为0.9 NA |
| D、标准状况下,2.24 L甲烷所含共价键数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 mol重水含有NA个D2O分子 |
| B、1 g氢气含有NA个H2分子 |
| C、2 mol钠与过量稀盐酸反应生成NA个H2分子 |
| D、22.4 L水含有NA个H2O分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、铝片碱洗时常有气泡:2Al+2OH-+2H2O═2AlO
| ||
B、Al2O3溶于氨水:Al2O3+2OH-═2AlO
| ||
C、AlCl3溶液中加入过量NaOH溶液:Al3++4OH-═AlO
| ||
D、实验室用铝盐制Al(OH)3:Al3++3NH3?H2O═Al(OH)3↓+3NH
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1173 kJ |
| B、1456 kJ |
| C、2022 kJ |
| D、2346 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:

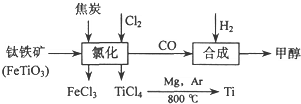
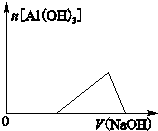
查看答案和解析>>
科目:高中化学 来源: 题型:
 常温下,用 0.1000mol/L NaOH 溶液分别滴定 20.00mL 0.1000mol/L HA 溶液(滴定曲线见图1)和20.00mL 0.1000mol/L HB溶液(滴定曲线见图2).下列说法正确的是( )
常温下,用 0.1000mol/L NaOH 溶液分别滴定 20.00mL 0.1000mol/L HA 溶液(滴定曲线见图1)和20.00mL 0.1000mol/L HB溶液(滴定曲线见图2).下列说法正确的是( )| A、图1可以表示NaOH滴定醋酸的曲线 |
| B、图1中B点状态时,溶液中有:c(Na+)=c(A-) |
| C、达到B、E状态时,反应消耗的n(HA)<n(HB) |
| D、当0mL<V(NaOH)<20.00mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(A-)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com