
【题目】氯酸钾和浓盐酸之间有下列反应:
![]() KClO3 +
KClO3 + ![]() HCl(浓)==
HCl(浓)== ![]() KCl +
KCl + ![]() Cl2↑+
Cl2↑+ ![]() ClO2 +
ClO2 + ![]() H2O。
H2O。
(1)配平上述方程式_____________________。
(2)该反应氧化剂是__________,氧化产物是___________。
(3)当有0.4mol电子发生转移时,生成的氯气的体积为_____L(标准状况)。被氧化的HCl的物质的量为____mol。
(4)若分别用①KMnO4(还原产物是Mn2+)②MnO2(还原产物是Mn2+)③Ca(ClO)2(还原产物是Cl2)与浓盐酸反应制备氯气,当浓盐酸足量且这三种氧化剂的物质的量相同时,生成氯气的物质的量最少的是________。
【答案】2 4 2 1 2 2 KClO3 Cl2 4.48 0.4 ②
【解析】
(1)根据电子守恒(或化合价升降相等)配平该反应;
(2)根据氧化剂、还原剂、氧化产物、还原产物的定义进行分析;
(3)根据2e--- Cl2--2HCl(被氧化)关系进行计算;
(4) 假设氧化剂都是1mol,然后根据氧化还原反应电子得失守恒计算出生成氯气的量,以此进行分析;
(1) KClO3 + HCl(浓)→ KCl + Cl2↑+ ClO2 + H2O反应中KClO3中氯元素+5价降低到+4价,变化了1价,HCl中氯元素-1价升高到+0价,生成了氯气,变化了2价,根据化合价升降总数相等,KClO3填系数2,Cl2填系数1,ClO2填系数2,最后根据原子守恒配平该反应,具体如下:2KClO3 +4HCl(浓)=2KCl+Cl2↑+2ClO2 +2H2O;
综上所述,本题答案是:2、4、2、1、2、2。
(2) 该反应中KClO3中的Cl元素化合价由+5价变为+4价,发生还原反应,所以氯酸钾是氧化剂;HCl中氯元素的化合价由-1价变为0价,发生氧化反应,浓盐酸是还原剂;所以发生还原反应的是KClO3,氧化产物是Cl2;
因此,本题正确答案是: KClO3;Cl2。
(3) 2KClO3 +4HCl(浓)=2KCl+Cl2↑+2ClO2 +2H2O反应发生后转移电子2e-;4molHCl(浓)参加反应,有2molHCl(浓)被氧化;根据2e--- Cl2--2HCl(被氧化)关系可知,当有0.4mol电子发生转移时,生成的氯气的体积为0.2×22.4=4.48L;被氧化的HCl的物质的量为0.4 mol。
综上所述,本题答案是:4.48, 0.4。
(4) 假设氧化剂都是1mol,①1mol KMnO4转移5mol电子,得到氯气2.5mol;②1mol MnO2转移2mol电子,得到氯气1mol;③Ca(ClO)2+4HCl=2Cl2+CaCl2+2H2O可知,1mol Ca(ClO)2参加反应生成2mol氯气;结合以上分析可知,生成氯气最少的是1mol MnO2,故②符合题;
综上所述,本题选②。


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
【题目】钛(Ti)被称为继铁、铝之后的第三金属,用TiO2制取Ti的主要反应有①TiO2+2C+2Cl2![]() TiCl4+2CO、②TiCl4+2Mg
TiCl4+2CO、②TiCl4+2Mg![]() 2MgCl2+Ti。下列叙述正确的是
2MgCl2+Ti。下列叙述正确的是
A. 反应①是置换反应 B. 反应②是复分解反应
C. 反应①中TiO2是氧化剂 D. 反应②中金属镁具有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大。
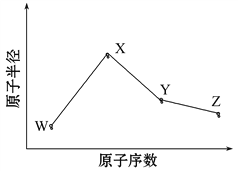
(1)X位于元素周期表中第________周期第________族;W的基态原子核外有________个未成对电子。
(2)Z的气态氢化物和溴化氢相比,较稳定的是________(写化学式)。
(3)Y与Z形成的化合物和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式是____________________________________________________。
(4)在25 ℃、101 kPa下,已知Y的气态氢化物在氧气中完全燃烧后恢复至原状态,平均每转移1 mol电子放热190.0 kJ,该反应的热化学方程式是_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 100mL MgCl2 和 AlCl3 混合溶液中,c(Cl-)=1.2mol/L,c(Mg2+)=0.3mol/L。欲使 Mg2+全部沉淀而分离出来,至少需 4 mol/L NaOH 溶液( )
A. 25mL B. 30mL C. 35mL D. 100mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取来两份等浓度的NaOH溶液A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.2mol/L的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,试回答下列问题:
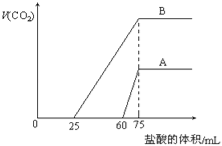
(1)原NaOH溶液的物质的量浓度为 mol/L.
(2)曲线A表明,原NaOH溶液中通入CO2后,所得溶液中的溶质为(写化学式) ;其物质的量之比为 .
(3)曲线B表明,原NaOH溶液中通入CO2后,所得溶液加盐酸产生CO2气体体积(标准状况)的最大值为 mL.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是 ( )
A. HF、HCl、H2S、PH3的稳定性依次增强
B. 按Mg、Si、N、F的顺序,原子半径由小变大
C. 某主族元素的电离能I1~I7数据如下表所示(单位:kJ/mol),可推测该元素位于元素周期表第ⅤA族

D. 在①P、S,②Mg、Ca,③Al、Si三组元素中,每组中第一电离能较大的元素的原子序数之和为41
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与应用的说法错误的是
A. 氧化钠可用作呼吸面具中的供氧剂
B. 氧化铝熔点高,常用于制造耐火材料
C. 硫酸钡可用作医疗上检查肠胃的“钡餐”
D. 甲醛可以使蛋白质变性,但不能用于食品保鲜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如右图所示,由此确定,原溶液中可能含有的阳离子是

A. Mg2+、Al3+、Fe2+ B. H+、Mg2+、Al3+
C. H+、Ba2+、Al3+ D. 只有Mg2+、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu在稀硝酸中可以发生如下反应:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O 下列叙述正确的是()
A. HNO3在反应中失去电子
B. 氧化产物与还原产物的物质的量比为3:2
C. 发生氧化反应的硝酸占参加反应硝酸的1/4
D. 每1 mol HNO3参加反应,有3 mol电子转移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com